Les
pathologies cardio-vasculaires
TABLE DES MATIERES
Les pathologies cardio-vasculaires *
TABLE DES MATIERES *
Calcul des probabilités d'infarctus par l'analyse des facteurs de risque *
L'indice de morbidité *
F Le sexe *
F La carrure *
La race *
F L'âge *
F L'hérédité *
F La tension *
La tension artérielle en fonction de la taille (en mmHg) *
Limites et données de la tension : *
Mesures au tensiomètre *
Contrôle de la tension à l'effort *
Modifications tensionnelles lors de la récupération *
F La fréquence cardiaque *
F Le tabac *
Le risque du tabagisme actif *
Le risque du tabagisme actif chez la femme *
Le tabagisme passif *
Les dangers du tabac pour le fœtus *
L'analyse du risque après arrêt du tabagisme *
Test de dépendance nicotinique *
F La surcharge pondérale *
Les formules de calcul du poids idéal *
F La sédentarité et l'exercice physique *
F Le ronflement nocturne ou ronchopathie *
F Les habitudes alimentaires *
F Le stress *
F Le profil psychologique *
Incidence de la dépression *
F Les analyses *
Taux de cholestérol *
Symptômes externes *
Le risque de la ménopause *
Taux de cholestérol LDL *
Taux de cholestérol HDL *
Taux de la LP(a) *
Taux des apoprotéines *
Rapports normaux de cholestérol *
Classification des hypercholestérolémies *
Taux des lipides totaux *
Taux des triglycérides *
Taux post-pandrial des triglycérides *
Taux de glycémie *
Le risque diabétique *
Taux d'acide urique *
Taux d’urée *
Taux de potassium (kaliémie) *
Taux de magnesium *
Taux de sodium *
Taux de calcium *
Taux de chlore *
Taux de créatinine *
Taux d'hémoglobine *
Taux d'albumine *
Taux de TSH *
Taux de vitamine E *
Les facteurs hématologiques *
L'addition des facteurs de risque *
Mode de calcul du risque cardio-vasculaire *
Les symptômes des pathologies cardio-vasculaires *
La douleur thoracique *
La dyspnée *
Les troubles du rythme *
Les syncopes *
Les malaises *
La mort subite *
Description des pathologies cardio-vasculaires *
La désadaptation à l'effort *
Complications de l'alitement *
Les pathologies veineuses *
les maladies aiguës *
les maladies chroniques *
Manifestations cliniques liées à l'insuffisance veineuse chez les obèses *
Physiopathologie du retour veineux *
Influence et dangers de l'amaigrissement *
Les insuffisances lymphatiques *
Le diabète *
Diabète de type I insulino-dépendant (DID) *
Diabète de type II non insulino-dépendant (DNID) *
Autres diabètes *
La maladie athéromateuse *
La plaque d'athérosclérose *
Atteinte athéromateuse des artères du membre inférieur : *
Atteinte athéromateuse des artères du cerveau *
Atteinte des petites artères et des artérioles *
Les accidents vasculaires cérébraux (AVC) *
L'accident vasculaire cérébral hémorragique (20%) *
L'accident ischémique cérébral du à l'athérosclérose (50%) *
L'accident ischémique transitoire (AIT) *
L'accident ischémique cérébral cardio-embolique (15-20%) *
L'accident ischémique cérébral du à la lipohyalinose (15 – 20%) *
L'insuffisance cardiaque *
Le choc cardiogénique *
Œdème aigu du poumon (OAP) *
Insuffisance cardiaque gauche *
Insuffisance cardiaque droite *
Le cœur d'athlète *
L'hypertrophie du ventricule gauche *
Troubles induits par l'HVG *
Moyens de détection de l'HVG *
Insuffisance globale des deux ventricules *
Le traitement des insuffisances cardiaques *
Les valvulopathies *
Différents types de valvulopathies *
sténose aortique *
Insuffisance aortique *
Sténose mitrale *
Insuffisance mitrale *
Sténose tricuspide *
Insuffisance tricuspide *
Le choix des prothèses valvulaires *
Le traitement des valvulopathies *
Les péricardites *
péricardite aiguë *
péricardite chronique *
Les péricardites de l'infarctus du myocarde *
L'embolie pulmonaire *
L'hypertension artérielle *
Les conséquences vasculaires de l'HTA *
Les conséquences cérébrales de l'HTA *
Les conséquences rénales de l'HTA *
HTA de l'enfant *
HTA et contraception orale *
Ménopause et HTA *
Age et HTA *
Conduite à tenir en cas d'HTA *
Régulation tensionnelle *
Rythme circadien *
Limites de tension au repos *
Effet blouse blanche *
Limites de tension à l'effort: *
Les symptômes *
Les complications *
Le traitement *
Mauvais contrôle de l'hypertension: *
L'hypertension artérielle gravidique *
Complications *
Les cardiopathies congénitales *
Les troubles du rythme cardiaque *
Extrasystoles *
Les bradycardies *
Les tachycardies *
La fibrillation ventriculaire (FV) *
La fibrillation auriculaire *
La dysplasie arythmogène du ventricule droit *
Les maladies d'origine coronariennes *
L'ischémie myocardique *
sténose d'une artère coronaire: *
spasme coronaire: *
thrombus: *
L'angine de poitrine ou crise d'angor *
L'angor instable *
Diagnostic différentiel de l'angine de poitrine *
L'infarctus du myocarde *
Caractéristiques *
Prise en charge de l'IDM en urgence *
La dépression chez les cardiaques *
Le rythme des accidents cardiaques *
La chirurgie cardiaque *
Les voies d'abord *
La circulation extracorporelle *
Les complications possibles de la chirurgie cardiaque *
Précautions pré-opératoires *
Précautions post-opératoires *
La chirurgie coronaire *
L'angioplastie coronaire transluminale *
La transplantation cardiaque *
La transplantation cardio-pulmonaire *
Autres interventions chirurgicales *
Nouvelles techniques chirurgicales *
La prise en charge secondaire de l'infarctus *
Evaluation et surveillance *
Contrôle des facteurs de risque et information du patient *
La réadaptation cardiaque *
Le traitement médicamenteux *
Les dérivés nitrés *
Les inhibiteurs du calcium (IC) *
Les anticoagulants (AC) *
Les bêtabloquants *
Les antiagrégants *
L'héparine *
Les anti-thrombotiques *
Les anti-vitamines K *
Les immunosuppresseurs *
Les inhibiteurs centraux *
Les a 1-bloquants *
Les digitaliques *
Les diurétiques *
Les hypolipidémiants *
Les inhibiteurs de l'enzyme de conversion (IEC) *
Mécanisme de l'angiotensine et de la bradykinine *
Les anxiolytiques et antidépresseurs *
Les antalgiques *
Les agonistes des canaux potassiques *
Les sydnonimines *
Choix de l'anti-hypertenseur en première intention *
La probabilité d'une pathologie cardiaque
est statistiquement aggravée par la présence d'un certain nombre de facteurs de
risque. Ces statistiques ont été mises en forme dans les tableaux ci-dessous
présentés par
Calcul des probabilités d'infarctus par l'analyse des
facteurs de risque
(tableaux proposés par
L'addition des points correspondants aux
réponses du patient détermine son risque.

|
SEXE |
Pt |
AGE |
Pt |
HEREDITE |
Pt |
|
Femme < 40 ans |
1 |
de 10 à 20 ans |
1 |
aucune |
1 |
|
Femme entre 40 et 50 ans |
2 |
de 21 à 30 ans |
2 |
1 parent ayant eu 1 MCV à plus de 60 ans |
2 |
|
Femme > 50 ans |
3 |
de 31 à 40 ans |
3 |
2 parents ayant eu 1 MCV à plus de 60 ans |
3 |
|
Homme |
5 |
de 41 à 50 ans |
4 |
1 parent ayant eu 1 MCV à moins de 60 ans |
4 |
|
Homme trapu |
6 |
de 51 à 60 ans |
6 |
2 parents ayant eu 1 MCV à moins de 60 ans |
6 |
|
Homme trapu et chauve |
7 |
>60 ans |
8 |
3 parents ayant eu 1 MCV à moins de 60 ans |
7 |
Nota: dans
l'hérédité, on ne compte que les parents, les grands-parents, sœurs et frères
ayant eu un infarctus ou une attaque. Une personne dont le père a été atteint
d'infarctus a un risque supplémentaire de 1.5. Ce risque passe à 3 si le père a
souffert en sus d'HTA.
|
Tension |
|
Tabac |
|
Régime |
|
Sur-charge pondé-rale |
|
Exercice |
|
|
10 |
1 |
Non fumeur |
0 |
Quasiment sans beurre ni huile |
1 |
< |
0 |
Travail actif et exercices intensifs |
1 |
|
12 |
2 |
Cigare et/ou pipe |
1 |
Grillades et légumes avec peu d'œufs et matières grasses |
2 |
moins de 2.5 à plus de |
1 |
Travail actif et exercices modérés |
2 |
|
14 |
3 |
10 à 20 cigarettes par jour |
2 |
normal avec œufs sans fritures ni sauces |
3 |
> 3 à |
2 |
Travail sédentaire et exercices intensifs |
3 |
|
16 |
4 |
20 à 30 cigarettes par jour |
4 |
normal avec quelques fritures sauces et matières grasses |
4 |
> de 10 à |
3 |
Travail sédentaire et exercice modérés |
5 |
|
18 |
6 |
30 à 40 cigarettes par jour |
6 |
riche avec souvent sauces, fritures, pâtisseries etc.. |
5 |
> de 16 à |
5 |
Travail sédentaire et peu d'exercices |
6 |
|
20 + |
8 |
> 40 cigarettes par jour |
10 |
Gastronomique avec abondance de sauces, fritures, pâtisseries |
7 |
> de |
7 |
Aucun exercice |
8 |
|
|
|
|
|
|
|
|
|
|
|
Nota: le
chiffre pris pour la tension est le nombre maxima (tension systolique). La
tension systolique limite est à 14 cmHg (centimètres de mercure), au-dessus de
16 cmHg le patient est en hypertension. La bonne tension diastolique (nombre
minimum) est 9 cmHg.
|
Risque de morbidité coronarienne par rapport à la moyenne de l'ensemble de la population selon les différents facteurs de risque d'après Framinghan |
||||||
|
Cholestérol |
Taux |
< 2.00 |
2.00 à 2.19 |
2.20 à 2.39 |
2.40 à 2.59 |
> 2.60 |
|
|
Risque |
0.49 |
0.70 |
0.80 |
1.37 |
1.92 |
|
Tabac |
Consommation (cigarettes/j) |
0 |
< 20 |
> 20 |
|
|
|
|
Risque |
0.69 |
1.26 |
1.58 |
|
|
|
Pression artérielle systolique |
Niveau (mmHg) |
< 120 |
120-139 |
140- 159 |
160- 179 |
> 179 |
|
|
Risque |
0.45 |
0.43 |
1.03 |
1.58 |
1.78 |
|
Obésité |
Surpoids |
< 10% |
0 |
> 10 % |
> 30% |
|
|
|
Risque |
0.51 |
0.81 |
1.3 |
2.41 |
|
|
Cumul des facteurs de risque |
Nombres positifs |
0 |
1 |
2 |
3 |
|
|
|
Risque |
0.6 |
1.12 |
2.01 |
6.34 |
|
Nota: l'indice de risque 1 correspond à la morbidité
moyenne de l'ensemble de la population.
Le tableau suivant présente pour
information d’autres calculs du risque.
|
Risques |
|
Hommes |
Femmes |
|
Tabac |
< 10 cigarettes/jour |
1.6 |
1.3 |
|
|
de 10 à 20 cigarettes/jour |
2.6 |
2.1 |
|
Hypertension |
Limite |
1.7 |
2.2 |
|
|
Déclarée |
2.7 |
3.6 |
|
Hypercholestérolémie |
|
2.4 |
1.5 |
|
Diabète |
|
2.5 |
5.7 |
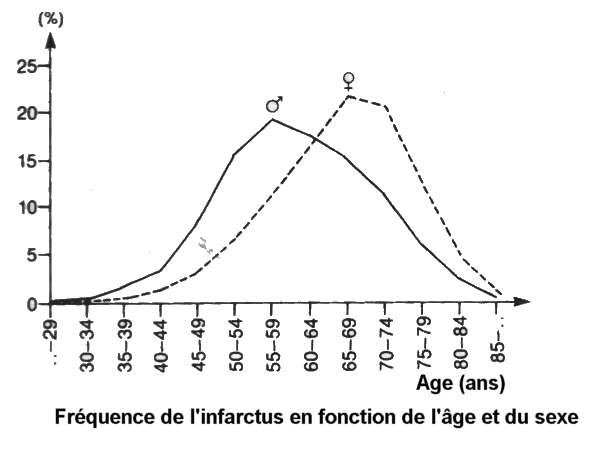
F Le sexe
L'athérosclérose, maladie des artères est
trois fois plus présente chez l'homme que chez la femme, chez qui elle est très
rare avant 50 ans, sauf si elle fume ou/et prend
Les femmes très obèses pendant leur post-ménopause courent un risque cinq
fois plus élevé de cancer de la muqueuse utérine.
Le risque d'infarctus est 8 fois plus élevé pour les hommes à la
quarantaine, mais est identique pour les deux sexes à 85 ans.



Actuellement et compte tenu des progrès
réalisés en matière de contraceptifs oraux, la pathologie coronaire associée à
la contraception orale se retrouve essentiellement chez des fumeuses de 35 ans.
Le traitement contraceptif oral seul
augmente la TAS de 5 à 10 mmHg et un peu moins la TAD; 5% seulement des femmes
souffrent de HTA du fait de la pilule, hors association avec le tabac; le
traitement hormonal doit être impérativement être changé et adapté à la
ménopause.
 Les femmes ayant une ménopause précoce, les femmes transformant leur
obésité gynoïde en obésité androïde après la ménopause courent un risque
cardio-vasculaire plus important. Pour les autres la ménopause engendrera
souvent d'autres troubles comme l'ostéoporose par exemple.
Les femmes ayant une ménopause précoce, les femmes transformant leur
obésité gynoïde en obésité androïde après la ménopause courent un risque
cardio-vasculaire plus important. Pour les autres la ménopause engendrera
souvent d'autres troubles comme l'ostéoporose par exemple.
 Le diabète chez la femme après la ménopause triple
l'incidence de maladie coronaire et multiplie par 10 le risque d'infarctus. Le
syndrome X qui associe obésité centrale, hyperinsulinisme ou diabète,
hypertriglycéridémie et HTA est particulièrement prédictif de la maladie
coronaire après
Le diabète chez la femme après la ménopause triple
l'incidence de maladie coronaire et multiplie par 10 le risque d'infarctus. Le
syndrome X qui associe obésité centrale, hyperinsulinisme ou diabète,
hypertriglycéridémie et HTA est particulièrement prédictif de la maladie
coronaire après
Le tabagisme de la femme, actuellement banalisé
est le facteur de risque le plus important pour la femme; quant au stress
engendré par la gestion conjointe difficile de la vie professionnelle et
familiale, il devient aujourd'hui un facteur de risque très important pour la
femme.
F La carrure
La carrure de l'homme
augmente son risque cardio-vasculaire, peut-être du fait d'une plus grande
capacité adipocytaire et d'une plus grande sensibilité aux lipides (?). Le fait
d'être chauve pour un homme trapu ou moyen majore son risque, car il signe une
activité hormonale défavorable.
Les sujets de race noire comme les
"African-Americans" ou Américains d'origine africaine ont un facteur
de risque cardio-vasculaire plus important que les sujets de race blanche.
- Le cholestérol affecte d'avantage les parois
artérielles; si on a retrouvé la même proportion de sujets atteints dans des
groupes de noirs et de blancs, on a par contre remarquer que la surface de
parois artérielles touchée était double chez les sujets de race noire. Le
risque d'attaque de ces sujets est donc plus rapide.
- Les taux d'intoxiqués tabagiques, de
diabétiques, les niveaux d'hypertension, et de cholestérol sont les mêmes dans
les deux groupes raciaux. Par contre les méfaits de l'hypertension se
manifestent plus tôt et avec des conséquences plus graves chez les sujets
noirs.
- Les taux d'hypertrophie ventriculaire
gauche sont plus importants chez les sujets de race noire.
- Les sujets de race noire ont des vaisseaux
plus rigides que ceux des blancs, ce qui explique que les b -bloquants
aient moins d'effet sur les sujets hypertendus noirs.
- 2.6% des blancs survivent à un arrêt
cardiaque pour 0.8% de noirs.
- Les femmes de race noire sont plus
sujettes au diabète (1.6 fois), 8% de femmes noires diabétiques pour 3% de
blanches,
-
connaissent plus d'épisodes d'angor que les hommes noirs
-
ont un facteur de risque de mort d'origine cardio-vasculaire plus
important.
- Il faut noter qu'en moyenne, les femmes
noires sont comparativement moins actives que les femmes blanches et que les hommes
noirs.
- Les femmes de race noire grossissent plus
vite et plus tôt que les blanches, notamment après chaque grossesse.
- Le facteur de stress du à l'isolement
touche plus les femmes noires que les blanches (22% des américaines d'origine
africaine entre 40 et 44 ans n'ont jamais été mariées pour 7% des américaines
de race blanche).
- Ces chiffres doivent néanmoins être
modérés par le fait que les américains d'origine africaine ont plus de
difficultés d'accéder aux soins que les américains blancs, engendrant ainsi des
conséquences plus graves et faussant les statistiques. Il est difficile de
faire la part des facteurs raciaux et des facteurs socio-économiques.
F L'âge
La maladie coronaire
est surtout présente entre 50 et 60 ans. Cependant la classe d'âge 30-50 est de
plus en plus touchée. Le risque de cardiopathie ischémique est 4 fois plus
important à 55 ans qu'à 40 ans. Entre 40 et 65 ans le risque d'infarctus double
tous les 10 ans.





F L'hérédité
Il existe un facteur
héréditaire favorisant les maladies coronaires dans certaines familles. Ce
facteur peut être intrinsèque (HTA, cholestérol, facteur autonome de
sensibilisation à la maladie) ou extrinsèque par les habitudes de vie
(alimentation, non-activité...) transmises à l'enfant et favorisant
ultérieurement le développement d'une cardiopathie.
Les sujets ayant des antécédents familiaux de maladie coronarienne
prématurée ont un risque de 2 à 5 fois plus important d'accident coronaire.
F La tension
L'hypertension artérielle est une pathologie
très grave qui touche près de 12% de la population des pays industrialisés. 3%
seulement de cette population est soignée, le reste ignorant cette maladie
insuffisamment médiatisée. Un certain nombre de symptômes permettent cependant
de suspecter une hypertension artérielle:
- impressions de
mouche volant devant les yeux,
- bourdonnements
d'oreilles
- vertiges
- malaises
- maux de tête
- palpitations
- essoufflement
rapide
|
Mesure |
Stade |
Nouveau contrôle |
|
Diastole |
||
|
< 85 |
normal |
dans 2 ans |
|
85 - 89 |
normal haut |
dans 1 an |
|
90 - 99 |
I moyen |
avant 2 mois |
|
100 - 109 |
II modéré |
avant 1 mois |
|
110 - 119 |
III sévère |
avant 1 semaine |
|
³ 120 |
IV grave |
immédiat |
|
Systole |
||
|
< 130 |
normal |
dans 2 ans |
|
130 - 139 |
normal haut |
dans 1 an |
|
140 - 159 |
I moyen |
avant 2 mois |
|
160 - 179 |
II modéré |
avant 1 mois |
|
180 - 209 |
III sévère |
avant 1 semaine |
|
³ 210 |
IV grave |
immédiat |
20% des sujets sont hypertendus légers et
sont à l'origine de 60% de la mortalité attribuée à l'hypertension. 90% des
hypertendus suivent leur traitement , mais seulement 60% ont une tension
normalisée.
Un traitement hypotenseur fait baisser de 33
à 40% le risque cérébral et de 14% à 26% le risque coronarien et de 21% le
risque cardio-vasculaire.
 L'hypertension artérielle est étudiée plus loin dans le chapitre réservé
aux pathologies.
L'hypertension artérielle est étudiée plus loin dans le chapitre réservé
aux pathologies.
Le risque cardio-vasculaire est multiplié
par 5.4 quand la valeur systolique atteint 19 et de 3.3 quand la valeur
diastolique atteint 11.
Si l'indice 100 correspond à la morbidité
moyenne, on note:
- un indice 45 si la tension < 120 mmHg
- un indice 83 si la tension est comprise
entre 120 et 139
- un indice 103 si la tension est comprise
entre 140 et 159
- un indice 158 si la tension est comprise
entre 160 et 179
- un indice 178 si la tension est > 180
mmHg
Le risque relatif de l'hypertendu de
développer
- une insuffisance coronarienne est estimé à
2.5 pour,
- un AVC ischémique est estimé à 9
- une insuffisance cardiaque est estimé à 5
La tension artérielle en fonction de la taille (en
mmHg)
|
|
TA médiane |
HTA limite |
HTA confirmée |
HTA dangereuse |
||||||||||||||
|
|
Systole |
Diastole |
Systole |
Diastole |
Systole |
Diastole |
Systole |
Diastole |
||||||||||
|
|
G |
F |
G |
F |
G |
F |
G |
F |
G |
F |
G |
F |
G |
F |
G |
F |
||
|
100 |
97.5 |
94 |
52.5 |
52 |
117.5 |
115 |
72.5 |
70 |
127.5 |
125 |
82.5 |
80 |
147.5 |
145 |
102.5 |
100 |
||
|
120 |
104 |
100 |
57.5 |
57.5 |
125 |
120 |
75 |
75 |
135 |
130 |
85 |
85 |
155 |
150 |
105 |
105 |
||
|
140 |
108 |
107 |
58 |
60 |
130 |
130 |
77.5 |
75 |
140 |
140 |
87.5 |
85 |
160 |
160 |
107.5 |
105 |
||
|
160 |
117 |
114 |
60 |
62 |
140 |
135 |
80 |
80 |
150 |
145 |
90 |
90 |
170 |
165 |
110 |
110 |
||
|
175 |
125 |
117 |
64 |
64 |
150 |
140 |
85 |
85 |
160 |
150 |
95 |
95 |
180 |
170 |
115 |
115 |
||
Limites et données de la tension :
è
L'hypertension artérielle est déterminée par plusieurs mesures à différents
moments de la journée, indiquant plus de 140/90 (hypertension limite) pour
è
Si la tension systolique est inférieure à 9 cmHg, il faut interdire l'exercice
è
La bonne tension diastolique moyenne (nombre minimum) est 9 cmHg, l'HTA est
caractérisée à partir de 9.5 cmHg. La tension diastolique caractérise les
résistances périphériques.
è
Au repos, la tension doit être plus faible que les valeurs indiquées ci-dessus
et ne pas dépasser 120 / 80 mmHg. La tension diminue pendant le sommeil
de 10 à 20% de la moyenne de la période d'éveil.
è
Le passage de la position couchée à la position debout ne doit pas entraîner
une chute de TAS > 3 cmHg
è
La réaction d'alarme dite "effet blouse blanche" majore la mesure de
pression artérielle et FC (PAS = +12 mmHg et PAD = + 8 mmHg).
è
Les valeurs de la mesure ambulatoire sont généralement plus basses que celles
mesurées occasionnellement à la consultation avec une différence de - 25 mmHg
pour la systolique et -10 à -15 mmHg pour la diastolique, surtout chez les
hypertendus.
 Le caoutchouc gonflable doit couvrir au moins la
moitié du bras, et s'arrêter environ
Le caoutchouc gonflable doit couvrir au moins la
moitié du bras, et s'arrêter environ
Gonfler d'abord le brassard jusqu'à occulter
le bruit distal radial, puis augmenter de 30 mmHg. La tension se prend
normalement sur le bras gauche, l'idéal étant de mesurer la tension sur les
deux bras et de conserver ensuite la mesure sur le bras présentant les valeurs
les plus hautes. La mesure s'effectue après 5 mn de repos; il est nécessaire de
refaire la mesure trois fois pour obtenir une mesure fiable, en laissant 1 mn
de repos entre chaque mesure, le brassard étant complètement déprimé.
Lors d'une crainte de chute de la tension
en position debout, mesurer la tension debout avant et pendant le traitement.
Faire de même pour les hypertensions.
La réduction de la pression dans le
brassard pendant la mesure ne doit pas excéder 2 à 3 mmHg par seconde.
Il existe des brassards plus grands ou plus
petits destinés à affiner la mesure en fonction de la taille du bras.


Contrôle
de la tension à l'effort
L'arrêt de l'exercice est impératif dans les
cas suivants :
G chute ou défaut d'augmentation de la tension
artérielle systolique
En dessous de 5
cmHg pour une Fc Max ³ 150 bat/min
En dessous de 3
cmHg pour une Fc Max < 115 bat/min
G augmentation anormale de la tension systolique
³ 22 cmHg pour 50% RFc
³ 25 cmHg pour un effort maximal
³ 28 cmHg pour un hypertendu actif en effort maximal
G augmentation de la tension diastolique plus
importante que l'augmentation de la tension systolique
G augmentation de la tension diastolique au-delà de 1
cmHg
G Pour un enfant arrêter l'exercice si PAS atteint 230
mmHg et PAD dépasse 120 mmHg.
Nota: quand le patient atteint VO2 Max, TAS diminue reflétant la
baisse du Volume d’Ejection Systolique VES et du débit cardiaque, accompagnant
le début du travail en anaérobie.
Modifications tensionnelles lors de la récupération
TAS diminue la 1ère minute, puis
remonte et diminue de nouveau progressivement jusqu'au retour à l'état initial
vers la 6ème minute.
F La fréquence cardiaque
 Au-dessus de 75 bpm au repos, la fréquence cardiaque est un marqueur
indépendant du risque cardio-vasculaire du fait du stress mécanique cyclique
qu'elle impose conjointement avec la pression à la paroi artérielle.
L'élévation de la fréquence cardiaque de repos est corrélée à l'élévation de la
pression artérielle, de la glycémie et des triglycérides. L'élévation de la
fréquence cardiaque contribue au développement de l'athérosclérose.
Au-dessus de 75 bpm au repos, la fréquence cardiaque est un marqueur
indépendant du risque cardio-vasculaire du fait du stress mécanique cyclique
qu'elle impose conjointement avec la pression à la paroi artérielle.
L'élévation de la fréquence cardiaque de repos est corrélée à l'élévation de la
pression artérielle, de la glycémie et des triglycérides. L'élévation de la
fréquence cardiaque contribue au développement de l'athérosclérose.
Un autre facteur important du risque
cardio-vasculaire est la réserve de fréquence cardiaque qui traduit la
possibilité de la FC à s'adapter. Une FC de repos basse et une FC Max basse
n'établit pas un bon indice de risque.

F Le tabac
Le tabac favorise :
-
une accélération du rythme cardiaque
-
une augmentation de la pression artérielle
-
l'athérome,
-
la formation de caillots sanguins
-
la diminution des capacités d'oxygénation de
l'organisme
-
l’augmentation du débit cardiaque nécessaire pour
un effort donné
-
le spasme des artères coronaires
-
une diminution de

L'inhalation de la fumée du tabac est
aggravante, car elle provoque instantanément un doublement ou un triplement de
la résistance des voies aériennes qui peut durer 10 à 30 minutes. A long terme
la fumée détermine une augmentation de la sécrétion dans les tractus
respiratoires et un rétrécissement des voies aériennes. VEMS et VMM peuvent
être réduites.
La résistance au passage de l’air au repos
est trois fois plus élevée tant chez des fumeurs de longue date que chez des
non-fumeurs qui viennent d’inhaler 15 bouffées de cigarette en 5 minutes. Cet
effet persiste durant 35 minutes environ et est peu marqué au cours d’un
exercice léger qui n’affecte que faiblement le coût énergétique de Ia
respiration. Au cours d’un exercice vigoureux cependant, cet effet pourrait
devenir nuisible car le surplus d’énergie nécessaire à la respiration peut
devenir prohibitif.
La bronchoconstriction qu’on observe chez
l’individu qui fume, n'est apparemment pas due à la nicotine mais à d’autres
particules contenues dans la fumée de cigarette qui la déclencheraient par voie
réflexe. Le tabac inhibe le fonctionnement des cils pulmonaires destinés à
filtrer les impuretés.
Le tabac augmente la fréquence cardiaque.
Par vasoconstriction, la nicotine augmente les résistances périphériques et
peut provoquer un spasme coronaire voire un infarctus. Une seule cigarette
inhibe la réserve coronaire, c'est à dire la possibilité des artères
nourricières de se dilater pour assumer une demande supplémentaire de sang
oxygéné. De ce fait, en cas d'infarctus, le défaut de réserve coronaire ne
permet pas au cœur de s'adapter et de limiter la nécrose.

l
3 cigarettes en 30 mn diminuent la performance aérobie de 14%.
l
Le tabac entraîne une augmentation d'adrénaline, noradrénaline (50%) et AGL de
50 à 150%.
l
A chaque bouffée ¼ de la nicotine atteint le cerveau en 7 secondes (14 secondes
pour l'héroïne) et provoque une réduction de 12.5% du débit cérébral.
l
Fumer après un effort peut provoquer un caillot par l'association de la
production d'adrénaline agrégante et de graisse dans le sang, ces substances
étant produites de manière plus importante par l'individu non entraîné.
l
La nicotine augmente TA de 1 à 2 Kpa
l
Fumer augmente les dépenses énergétiques de 14%, d’où la propension à grossir
des fumeurs qui arrêtent le tabac.
Le tabac multiplie le risque de maladie
coronaire par 1.4 pour moins de 5 cigarettes par jour, 2.1 de 5 à 10
cigarettes, 2.4 pour 10 à 15 cigarettes, 2.8 entre 20 et 40 cigarettes par jour
et par 5 pour 40 cigarettes et plus par jour. Il est de 0.7 pour un non fumeur.
La mortalité avant 50 ans est 5 fois plus grande chez les fumeurs que chez les
non-fumeurs.
On peut estimer que chaque cigarette fumée par un fumeur qui décède à 55
ans après avoir fumé 40 cigarettes par jour pendant 40 ans, lui a coûté
approximativement 15 minutes de vie.
Le
risque du tabagisme actif chez la femme
La pilule contraceptive associée au tabac
multiplie par 15 le risque cardio-vasculaire en diminuant la protection
hormonale dont bénéficie
-
33% des 12-18 ans et 50% des 20-24 ans fument
-
12% des fumeuses fument plus de 25 cigarettes par jour
L'association pilule tabac chez la femme
favorise les thromboses. La pilule fait courir un risque faible mais réel de
cancer du sein dans les 10 premières années.
Les fumeuses de plus de 50
ans dépassant la dose de 25 cigarettes quotidiennes ont 2.5 fois plus de
risques que des non fumeuses de développer une dégénérescence maculaire
entraînant une perte de vision irréversible. Le risque est pratiquement
identique pour les fumeurs. Le fait d'avoir abandonné le tabac depuis 15 ans ou
plus, n'entraîne qu'une petite diminution du risque. La dégénérescence
maculaire touche 10% de la population entre 65 et 75 ans, et 30% au-delà de 75
ans, soit actuellement en France plus de un million de personnes dont 30 000 au
stade de
La femme qui fume coure un risque d'IDM de
5.8 et un risque de décès par maladie coronaire de 5.5. Le cancer du poumon est
devenu la première cause de mortalité par cancer chez
L'exposition passive à la fumée de cigarette
pendant 15 mn provoque une augmentation des taux sanguins de nicotine et de
carboxyhémoglobine, déclenche une réponse sympathique nerveuse et une
augmentation des résistances périphériques, mais n'entraîne pas de modification
de la fréquence cardiaque, ni de la pression artérielle.
Le risque lié au tabagisme passif d'un
individu soumis à un environnement fumeur augmente globalement de 35%. Il
s'accroît avec le nombre de cigarettes fumées par le conjoint et le nombre
d'années d'exposition. Il est majoré par une exposition au tabagisme dans
l'environnement professionnel et dans l'enfance.
5% des cancers qui ne sont pas dus au
tabagisme actif le sont du fait du tabagisme du conjoint. Une étude a relevé
une augmentation de 23% de la mortalité d'origine coronarienne chez des hommes
non fumeurs mariés à des fumeuses par rapport à un groupe marié à des non
fumeuses et 19% chez des femmes mariées à des fumeurs. On estime à 3000 le nombre
de décès du au tabagisme passif chaque année en France et à 50 000 aux USA.
9 millions d'enfants américains de moins de
5 ans vivent avec au moins un fumeur et sont exposés toute la journée au risque
du tabagisme passif. 300 000 cas annuels d'infections des voies respiratoires
comme pneumonies et bronchites de bébés de moins de 18 mois, dont 15 000
doivent être hospitalisés sont le fait du tabagisme passif.
Les
dangers du tabac pour le fœtus
Le tabagisme passif est nocif pour le fœtus.
Il diminue le poids du bébé de
L'analyse du risque après arrêt du tabagisme
Le risque cardio vasculaire diminue de 50%
la première année qui suit l'arrêt du tabac. Il faut 10 à 20 ans pour revenir
au risque cardio-vasculaire néant du non fumeur. Après 40 ans, l'arrêt du
tabac, ne permettra jamais de revenir au risque zéro, et le tabac laissera
toujours des traces.
Test de
dépendance nicotinique
L'accoutumance au tabac provient d'un
déficit (40%) en MAO (mono-amine-oxydase) de type B. Il s'agit d'un
neuro-transmetteur qui dégrade habituellement
|
Test de dépendance nicotinique |
||||
|
Question |
0 point |
1 point |
2 points |
Score |
|
Combien de temps après votre réveil fumez vous votre première cigarette ? |
Après 30 minutes |
Avant 30 minutes |
|
|
|
Trouvez vous difficile de ne pas fumer dans les lieux ou cela est interdit ? |
Non |
Oui |
|
|
|
Quelle cigarette fumez-vous avec le plus de plaisir ? |
aucune |
la première |
|
|
|
Combien de cigarettes fumez-vous quotidiennement ? |
1 à 15 |
16 à 25 |
Plus de 25 |
|
|
Fumez vous plus dans la matinée que dans le reste de la journée ? |
Non |
Oui |
|
|
|
Fumez vous quand vous êtes malade au point de rester au lit ? |
Non |
Oui |
|
|
|
Quel taux de nicotine contiennent les cigarettes que vous fumez ? |
Bas |
Moyen |
Haut |
|
|
Inhalez vous la fumée ? |
Jamais |
Quelquefois |
Souvent |
|
Résultats du test :
score de 0 à 3 : faible dépendance
score de 4 à 7 : dépendance moyenne
score au-delà de 7 : forte dépendance
F La surcharge pondérale
La surcharge adipeuse (terme plus exact que
celui de surcharge pondérale) est un élément important du risque
cardio-vasculaire par la surcharge de travail qu'elle impose au cœur et parce
qu'elle signe généralement la présence d'autres facteurs de risque comme
hyperlipidémie, hypercholestérolémie, hypertension... Les dépôts adipeux abdominaux
chez l'homme après 40 ans sont potentiellement mortels, car ils induisent
ultérieurement cancers et cardiopathies. Il est notable que n'a jamais été
recensé un centenaire mâle obèse.
Le poids corporel idéal est celui des ses 20
ans.
Le risque de présenter une angine de
poitrine dans les 10 ans est multiplié par 2 chez les personnes présentant un
excès de poids de 20% et par 5 pour un excès de poids de 30%. La personne obèse
a 2,5 fois plus de risques de mourir d’une maladie cardio-vasculaire qu’une personne
dont le poids est inférieur ou égal à
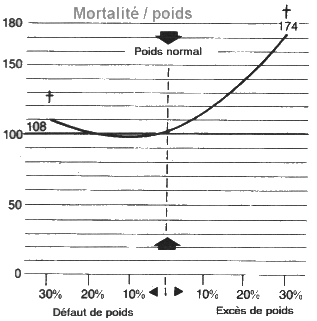


Les formules
de calcul du poids idéal
Ø
la formule de Broca : Taille en cm - 100
Ø la
formule de Lorenz : pour l'homme (Taille en cm - 100) - Taille - 150
4
pour la femme (Taille en cm - 100) - Taille -
150
2,5
Ø
la formule de Pende : Taille / poids £ 2,4
Ø
la formule des assurances-vie américaines : (Taille - 150) x 3 + 50
4
Ø la
formule de Creef (Taille en cm - 100) + âge x 0,9
10
La formule de Boura
Pi (kg) = Pr (kg) –[PSS en 10ème mm
–75] x [0.003 T en cm – 0.384]
Pi = poids idéal
Pr = poids réel
PSS = pli sous-scapulaire
T = taille
Ø le Body
mass index (BMI) ou index de masse corporelle : poids/taille2 en
mètres. Si le résultat se trouve :
entre 18 et 20 l'adulte
est plutôt mince
entre 20 et 25 (H) le poids est idéal
entre 19 et 24 (F) le poids est idéal
entre 25 et 30 l'adulte présente un surpoids
entre 30 et 40 l'adulte est obèse
au-dessus de 40 obésité morbide
|
Taille |
Homme |
Femme |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|


Autre tableau de calcul du poids normal
(plus fin)
|
Homme de 20à 29 ans |
|
Femme de 25 ans à 30 ans |
||||||||||||
|
Taille |
Carrure étroite |
Carrure moyenne |
Carrure large |
|
Taille |
Carrure étroite |
Carrure moyenne |
Carrure large |
||||||
|
m |
kg |
kg |
kg |
|
m |
kg |
kg |
kg |
||||||
|
1.58 |
51-54 |
53-58 |
57-64 |
|
1.48 |
42-44 |
43-48 |
47-54 |
||||||
|
1.60 |
52-56 |
55-60 |
58-65 |
|
1.50 |
43-46 |
44-50 |
48-55 |
||||||
|
1.62 |
53-57 |
56-62 |
60-67 |
|
1.52 |
44-47 |
46-51 |
49-57 |
||||||
|
1.65 |
55-58 |
57-63 |
61-69 |
|
1.55 |
45-49 |
47-52 |
51-58 |
||||||
|
1.68 |
56-60 |
59-65 |
62-71 |
|
1.58 |
46-50 |
49-54 |
52-59 |
||||||
|
1.70 |
58-62 |
61-67 |
64-73 |
|
1.60 |
47-51 |
50-55 |
53-61 |
||||||
|
1.73 |
60-64 |
63-69 |
66-75 |
|
1.62 |
49-52 |
51-57 |
55-62 |
||||||
|
1.75 |
62-66 |
64-71 |
68-77 |
|
1.65 |
50-54 |
52-59 |
57-64 |
||||||
|
1.78 |
63-68 |
66-72 |
70-79 |
|
1.68 |
52-56 |
54-61 |
58-66 |
||||||
|
1.80 |
65-70 |
68-75 |
72-81 |
|
1.70 |
53-57 |
56-63 |
60-68 |
||||||
|
1.83 |
67-72 |
70-77 |
74-83 |
|
1.73 |
55-59 |
58-65 |
62-70 |
||||||
|
1.85 |
69-73 |
72-79 |
76-85 |
|
1.75 |
57-61 |
60-67 |
64-71 |
||||||
|
1.88 |
71-76 |
73-81 |
78-88 |
|
1.78 |
59-63 |
62-68 |
66-74 |
||||||
|
1.90 |
72-77 |
76-84 |
81-90 |
|
1.80 |
61-65 |
63-70 |
67-76 |
||||||
|
1.93 |
74-79 |
76-86 |
82-92 |
|
1.83 |
63-67 |
65-72 |
69-78 |
||||||
|
|
||||||||||||||
|
Pour les femmes âgées de 18 à 25 ans soustraire 1/2 kg par année en dessous de 25 ans |
||||||||||||||
|
Table de poids des compagnies d'assurance américaines |
||||||||||||||
|
|
Hommes |
Femmes |
||||||||||||
|
|
Poids idéal - 20% |
Poids de référence |
Limite maximum + 20% |
Poids idéal - 20% |
Poids de référence |
Limite maximum + 20% |
||||||||
|
147 |
|
|
|
41.4 |
51.7 |
62.1 |
||||||||
|
149 |
|
|
|
42.3 |
52.8 |
63.4 |
||||||||
|
152 |
|
|
|
43.2 |
54.0 |
64.8 |
||||||||
|
154 |
|
|
|
44.3 |
55.3 |
66.4 |
||||||||
|
157 |
48.3 |
60.3 |
72.4 |
45.4 |
56.7 |
68.0 |
||||||||
|
160 |
49.0 |
61.2 |
73.5 |
46.4 |
58.1 |
69.7 |
||||||||
|
162 |
49.9 |
62.4 |
74.8 |
47.5 |
59.4 |
71.3 |
||||||||
|
165 |
50.8 |
63.5 |
76.2 |
48.6 |
60.8 |
72.9 |
||||||||
|
167 |
51.9 |
64.9 |
77.8 |
49.7 |
62.1 |
74.6 |
||||||||
|
170 |
53.0 |
66.2 |
79.5 |
50.8 |
63.5 |
76.2 |
||||||||
|
172 |
54.0 |
67.6 |
81.1 |
51.9 |
64.9 |
77.8 |
||||||||
|
175 |
55.2 |
68.9 |
82.7 |
53.0 |
66.2 |
79.5 |
||||||||
|
177 |
56.2 |
70.3 |
84.4 |
54.1 |
67.6 |
81.1 |
||||||||
|
180 |
57.5 |
71.9 |
86.3 |
55.2 |
68.9 |
82.7 |
||||||||
|
182 |
58.8 |
73.5 |
88.2 |
|
|
|
||||||||
|
185 |
60.2 |
75.3 |
90.4 |
|
|
|
||||||||
|
187 |
61.5 |
76.9 |
92.3 |
|
|
|
||||||||
|
190 |
63.1 |
78.9 |
94.7 |
|
|
|
||||||||
ð Calcul de la masse grasse idéale pour l'homme
=
poids idéal x 15 %
ð Calcul de la masse grasse idéale pour la femme
=
poids idéal x 27%
ð Calcul de la masse grasse totale pour l'homme
=
poids réel - (poids idéal x 85%)
ð Calcul de la masse grasse totale pour la femme
=
poids réel - (poids idéal x 73%)
ð % de masse grasse = masse grasse totale x 100
poids
réel
Limites basses de l'obésité physiologique
ð 20%
de masse grasse chez le jeune homme (jusqu'à 35 ans)
ð 25%
de masse grasse chez l'homme plus âgé
ð 31%
de masse grasse chez la jeune femme (17 à 27 ans)
ð 37%
de masse grasse chez la femme plus âgée
F Différencier l'obésité physiologique de l'obésité
médicale pathologique.
|
Masse grasse idéale |
Homme de référence |
% de dérive |
% de masse grasse |
Femme de référence |
% de dérive |
% de masse grasse |
|
20 ans |
|
|
15.00 |
|
|
27.00 |
|
30 ans |
|
5 |
15.75 |
|
3.12 |
27.84 |
|
45 ans |
|
33 |
20.00 |
|
9.37 |
29.53 |
|
>50 ans |
|
45.83 |
21.87 |
|
18.75 |
32.06 |
F La sédentarité et l'exercice
physique
 F Il semble exister un
seuil énergétique de 2000 Kcal / semaine au-delà duquel le risque de maladie
coronarienne est diminué de 50%. Une dépense journalière de 300 Kcal (une ½
heure à une heure de marche rapide ou 30 mn de jogging par jour) suffit à
diminuer largement le risque d'HTA et de maladie coronaire.
F Il semble exister un
seuil énergétique de 2000 Kcal / semaine au-delà duquel le risque de maladie
coronarienne est diminué de 50%. Une dépense journalière de 300 Kcal (une ½
heure à une heure de marche rapide ou 30 mn de jogging par jour) suffit à
diminuer largement le risque d'HTA et de maladie coronaire.
La modification du rapport HDL / LDL demande
un travail hebdomadaire de 1000 Kcal / semaine, un autre stade présentant un
rapport plus important se situe à 5000 Kcal / semaine.
Le risque CV est réduit de 35 à 55% par
l'adoption d'un programme d'exercice physique (le risque cardio-vasculaire est
de 1.9 pour les sédentaires).
La sédentarité induit la difficulté à oxyder les acides gras et donc un
déséquilibre au profit des hydrates avec production de lactates et de fatigue.
Une méga-étude américaine sur 8 ans met en évidence un quasi doublement
du risque de décès chez les personnes en mauvaise condition physique.
Effets sur la teneur corporelle en
eau et en graisse d'un programme de jogging pendant deux mois
Une dépense quotidienne supplémentaire de 1500 kJ
(360 cal) réalisée en 10 minutes de jogging modéré entraîne la disparition de
Durant les trois premiers jours du programme, les pertes d’eau représentent 70% de la perte totale. Les pertes d’eau diminuent ensuite progressivement pour ne représenter que 19% entre le onzième et le treizième jour.
En même temps, la perte de lipides passe de 25 à 69%. A partir du vingt et unième jour, les lipides représentent 85% de la perte totale, sans augmentation correspondante de la perte d’eau. La part des protides passe de 5% au début à 12% entre le onzième et le treizième jour et à 15% à la fin du programme.

Risque d'AVC en fonction de l'activité
dans les loisirs:
- de 1 pour les inactifs,
- 0.6 pour les modérément
- 0.3 pour les actifs
Le risque d'arrêt cardiaque d'un actif
est de 40% de celui d'un sédentaire
Une activité physique modérée pendant les
moments de loisirs assure une baisse de 70% de la mortalité totale et de 63%
des événements cardio-vasculaires.
F Le ronflement nocturne ou
ronchopathie
La ronchopathie ou ronflement nocturne est un facteur de risque
cardio-vasculaire pour la plupart des ronfleurs, car elle est associée à
l'hypertension artérielle qui ne baisse pas la nuit chez les ronfleurs.
F Les habitudes alimentaires
Les données diététiques font l'objet d'un
chapitre entier de cet ouvrage. Pour mémoire, rappelons les éléments les plus
importants:
± la
composition alimentaire idéale est de
G
15% de protides avec un rapport protides animaux ³
1
protides végétaux
G
30% de lipides avec un rapport lipides végétaux et marins ³
2/5
lipides totaux
G
55% de glucides
dont 4% maximum
(déconseillé) de calories d'origine alcoolique
(
avec un rapport calories
des sucres solubles ³ 1/10 (250 cal)
calories totales
G
1 ml d'eau par calorie (= 2500 ml)
G Les
règles élémentaires :
±
quantité à satiété
±
suppression de l'alcool, sauf un verre de vin par jour (diminution de 30 à
40% du risque cardio vasculaire
±
hypoglucidique
±
hypolipidique
±
hyperprotidique (minimum 1g de protéines par Kg de poids corporel)
±
modérément hyposodé (diminution de l'appétit)
±
large consommation de fibres alimentaires
±
beaucoup d'eau (2 à
±
mastiquer lentement
± alcool
± graisses, margarine
± fritures
± mayonnaise et autres sauces
à base d'huile
± charcuterie
± gibier faisandé cuisiné en
sauce
± porc et mouton gras
± sucreries
± entremets, crèmes
± glace et sorbets (sauf avec
édulcorant)
F Le stress
Le stress génère une
hyperactivité du système sympathique avec production de catécholamines
(adrénaline) et augmentation de la tension, de la fréquence cardiaque, de la
glycémie et du taux de lipides sanguins. Le stress peut parfois faire battre le
cœur au-delà de la fréquence maximale théorique, et double facilement la
fréquence de base. Or, le simple fait d'augmenter sa fréquence de 10 battements
minute augmente le travail du cœur de 15%. Le stress oblige donc le cœur à un
travail supplémentaire inutile et crée les conditions d'une usure prématurée
(insuffisance cardiaque) ou d'un accident.
La préoccupation mentale, comme le stress,
augmentent
Le stress est en importance le troisième
facteur de risque. Le stress chronique est plus délétère que le stress aigu. Le
manque de relation sociale multiplie le risque de mortalité coronarienne par 2
chez l'homme et par 3 chez

Le stress provoque un besoin de glucides
pour provoquer une réaction insulinique, déclenchante du sommeil. Associé à la
production de suc gastrique déclenché par le stress et aboutissant à l'ulcère
gastrique, ces deux mécanismes induisent un besoin impératif de manger et
essentiellement manger sucré.
F Le profil psychologique
Les personnes possédant un caractère de type
A ont un risque 4 fois plus important de développer une maladie
cardio-vasculaire. Les patients de type D ont un facteur de risque encore plus
élevé.
Le profil psychologique dit de type A caractérise un individu plutôt hyperactif, acharné à la compétition, exigeant, impulsif.
Type A: attitude compétitive, état d'esprit ouvert à la contestation, agressivité, objectifs ambitieux, besoin de reconnaissance, de responsabilités, difficultés à déléguer, à exister en dehors de l'activité professionnelle, exigences élevées, horaires de travail démesurés, tendance au déni et à l'insomnie, paroles martelées, gestes vifs, coupure facile de la parole à autrui
Ce type de comportement génère une hyperactivité du système sympathique avec augmentation des catécholamines, de l'activité cardiaque, de la tension artérielle et est retrouvé dans 58% des accidents cardiaques.
Type D: individus soucieux, ombrageux et socialement aliénés, inhibant leurs émotions négatives; ils ont 4 fois plus de risques à 3 ans de mourir après un épisode coronarien que les patients dotés d'un tempérament enjoué.
La présence d'une dépression est un facteur
de risque indépendant des autres facteurs psychologiques; elle multiplie par
deux le risque de survenue d'une insuffisance coronaire, avec un risque plus
élevé d'IDM que d'angine de poitrine.
L'épuisement vital est différent de la
dépression, il se définit par une fatigue inhabituelle, un sentiment de
découragement, une irritabilité, une baisse de la libido, et des troubles du
sommeil. Il présente néanmoins le même risque que la dépression.
La dépression génère une hyperactivité
sympathique, un dysfonctionnement du métabolisme des lipides avec augmentation
du CT, et une possibilité de troubles de la coagulation.
La dépression est relevée dans 33 à 50% des
cas d'infarctus, 18% des patients étant en dépression majeure, et 27%
présentant des symptômes de dépression. Les patients dépressifs ont cinq fois
plus de mortalité à 6 mois.
|
|
Taux de cholestérol |
Points |
|
|
< 180 mg/litre |
1 |
|
Taux normal |
181 à 205 mg/litre |
2 |
|
Taux limite |
206 à 230 mg/litre |
3 |
|
|
231 à 255 mg/litre |
4 |
|
Taux élevé |
256 à 280 mg/litre |
5 |
|
|
281 à 300 mg/litre |
7 |
Le cholestérol doit être inférieur ou égal à 1.80 g/l avant 20 ans et à
Il est nécessaire de quantifier la cholestérolémie quand elle dépasse 2 à
2.15 g/l. En cas d'excès marqué du HDL (0.55 g/l pour l'homme et 0.70 g/l pour
la femme), il n'existe guère de risques cardio-vasculaires.
L'athérosclérose débute au-dessus de 2.15 g/l
La diététique seule, ne permet un abaissement du cholestérol que de 8 à
15% en six mois, il faut donc faire appel aux médicaments pour obtenir une
baisse supérieure.
Ne pas adopter un régime diminuant la ration journalière de plus de 500
Kcal, sous peine d'abandon.
Le risque cardio-vasculaire est de: 1
pour un cholestérol £ 1
(étude de Framingham) 1.2
pour un cholestérol entre 2 et 2.19
1.6
pour un cholestérol entre 2.20 et 2.39
2.25
pour un cholestérol entre 2.40 et 2.59
3.25
pour un cholestérol > 2.60
Baisser la cholestérolémie de 1% diminue le risque cardio-vasculaire de 2
à 3% et le risque d'AVC de 30%
|
Risque relatif de cardiopathie ischémique en fonction de la pression artérielle systolique et du cholestérol total |
||||||
|
PAS \ CT |
1.60 |
2 |
2.40 |
2.80 |
3.20 |
3.60 |
|
12 |
1 |
1.4 |
1.9 |
2.6 |
3.5 |
4.9 |
|
14 |
1.4 |
1.9 |
2.6 |
3.5 |
4.9 |
6.7 |
|
16 |
1.9 |
2.6 |
3.5 |
4.9 |
6.7 |
9.1 |
|
18 |
2.6 |
3.5 |
4.9 |
6.7 |
9.1 |
12.5 |
|
20 |
3.5 |
4.9 |
6.7 |
9.1 |
12.5 |
17.2 |
|
22 |
4.0 |
6.7 |
9.1 |
12.5 |
17.2 |
23.6 |
|
Incidence du tabac et du diabète sur le risque précédent |
|
|
Nombre de cigarettes par jour |
Coefficient multiplicateur |
|
10 |
1.4 |
|
20 |
1.9 |
|
30 |
2.5 |
|
40 |
3.5 |
|
Diabète |
2.3 |
Xanthomatose éruptive (triglycéridémie >
10 g/l)

Xanthomes tendineux (cholestérolémies > 6
g/l): ils siègent sur les tendons extenseurs des doigts de la main et sur les
tendons d'Achille.

Xanthélasmas: soit localisé à la partie
interne des paupières supérieures et inférieures, soit largement étalé.

Arc cornéen: dépôt de cholestérol à la
périphérie de
Obésité dystrophique
Hépatomégalie accompagnée ou non de
splénomégalie
Crises abdominales douloureuses de
pathogénie souvent obscure.
Le risque relatif des femmes ménopausées non
traitées par rapport aux femmes ménopausées du même âge est entre 2.2 et 2.7.
Le traitement diminue ce risque de 50%, c'est à dire ramène le risque
légèrement au-dessus de celui de la femme non ménopausée.
La ménopause augmente les taux de lipides
athérogènes et diminue
|
|
favorable |
normal |
défavorable |
|
Hommes |
> 55 mg/dl |
35-55 |
< 35 mg/dl |
|
Femmes |
> 65 mg/dl |
45-65 |
< 45 mg/dl |
Le taux de HDL est diminué
par les androgènes, la progestérone, les pilules contraceptives, le tabagisme.
Le taux de HDL est augmenté par les œstrogènes, l'alcool et
l'entraînement en endurance L'exercice physique régulier et la suppression du
tabac favorisent la diminution du taux de cholestérol et améliorent le profil
des lipoprotéines.
Une réduction du cholestérol de 1% entraîne une réduction du risque
cardio-vasculaire de 2%. Le HDL augmente l'activité des enzymes plasmatiques
chargés d'éliminer les lipides sanguins.
Une diminution des HDL de 5 mg/100 ml augmente le risque d'infarctus de
25%.
|
HDL Cholestérol |
Hommes |
Femmes |
|
0.75 |
Syndrome de longévité |
Syndrome de longévité |
|
0.70 |
|
0.52 |
|
0.65 |
0.45 |
0.64 |
|
0.60 |
0.55 |
0.80 |
|
0.55 |
0.67 |
Risque standard 1 |
|
0.50 |
0.82 |
1.25 |
|
0.45 |
Risque standard 1 |
1.25 |
|
0.40 |
1.25 |
|
|
0.35 |
1.50 |
|
|
0.30 |
1.75 |
|
|
0.25 |
2.00 |
|
Taux de cholestérol LDL
Un taux normal est inférieur à 1.50 g/l
Un taux entre 1,50 et 1,60 n'est traité que si il est accompagné d'autres facteurs de risque. Entre 1.6 et 1.9 imposer des mesures hygiéno-diététiques; Au-dessus de 1.9 ou 1.6 associé à des facteurs de risque, le patient doit prendre un hypolipidémiant.
Un taux supérieur à 1,60 est défavorable
Chez les sujets ayant déclaré une maladie artérielle, la fraction de LDL doit être inférieure à 1 g/l.
Se calcule par la formule de Friedewald:
Ch-LDL = CT – Ch-HDL – TG/5 (en g/l)
Le LDL se dépose sur la paroi des artères participant à la construction
des plaques d'athérome. Le HDL inhibe la pénétration des LDL dans la paroi
vasculaire et mobilise le cholestérol, les LDL et VLDL qu'il transporte vers le
foie.

|
HDL Cholestérol |
Hommes |
Femmes |
|
0.75 |
Syndrome de longévité |
Syndrome de longévité |
|
0.70 |
|
0.52 |
|
0.65 |
0.45 |
0.64 |
|
0.60 |
0.55 |
0.80 |
|
0.55 |
0.67 |
Risque standard 1 |
|
0.50 |
0.82 |
1.25 |
|
0.45 |
Risque standard 1 |
1.25 |
|
0.40 |
1.25 |
|
|
0.35 |
1.50 |
|
|
0.30 |
1.75 |
|
|
0.25 |
2.00 |
|
Taux de la LP(a)
Il s'agit d'une lipoprotéine présente en quantité élevée chez les
coronariens (notamment après infarctus) qui perturbe la coagulation et implique
un risque de "caillots sauvages". C'est un facteur d'athérosclérose
indépendant. Son taux d'alerte est à 0.30 g/l., réévalué à 0.45 par suite de
modifications techniques de dosage.
apoprotéine A1
pour les lipoprotéines HDL :
taux normal >
1.0 g/l
apoprotéine B
pour les lipoprotéines LDL :
taux normal <
1.3 g/l
|
Lipoprotéines |
% |
Quantité cholestérol |
|
pré-b |
15 |
0.24 g/l |
|
b |
50 |
1.80 |
|
a |
35 |
0.56 |
|
Total |
100 |
2.60 |
Rapports normaux de cholestérol
Cholestérol HDL / cholestérol total ³ 0.20
Cholestérol HDL / cholestérol LDL + VLDL ³ 0.25
Cholestérol LDL + VLDL / cholestérol HDL < 5
Cholestérol LDL / cholestérol HDL < 3.5
Cholestérol total / cholestérol HDL < 6
|
Cholestérol total / cholestérol HDL |
||
|
Hommes |
Femmes |
Risque relatif |
|
3.43 |
3.27 |
0.5 |
|
4.97 |
4.44 |
1 |
|
9.55 |
7.05 |
2 |
|
23.39 |
11.04 |
3 |
|
C Total C-HDL |
2 g/l |
2 – 2.5 |
2.51 – 3 |
>3 |
|
< 0.35 g/l |
1.5 |
10.5 |
17.1 |
20 |
|
0.35 – 0.55 |
1 |
0.9 |
2.2 |
8.1 |
|
> 0.55 |
0.9 |
0.6 |
1.2 |
5.3 |
Cet indice d'athérogénicité indique un
risque augmenté quand il est > 4.5
Cholestérol lipoprotéines à apoprotéines
A >
0.60
Cholestérol lipoprotéines à apoprotéines B
Triglycérides / cholestérol total
Le taux de cholestérol pouvant varier selon
les conditions diététiques, l'heure, la saison et de 0.20 g/l d'un jour à
l'autre, il est nécessaire d'affiner le diagnostic, quand c'est possible, par plusieurs
mesures à plusieurs semaines d'intervalles.
Classification
des hypercholestérolémies
Limite ou secondaire: CT = 2 à 2.5 g/l
Modérée: CT = 2.5 à 3 g/l
Sévère: CT > 3 g/l
autour de
entre 0.5 à
Une élévation de 1 mmol/l soit 0.87 g/l
accroît de 14% chez l'homme et de 37% chez la femme, le risque coronarien. Les
patients avec un taux de triglycérides > 2 g/l présentent un risque double
de ceux dont le taux est < 1.50 g/l.
L'élévation des triglycérides est l'anomalie
la plus fréquente chez des survivants d'IDM.
Taux
post-pandrial des triglycérides
Les dosages habituels des lipides sont
réalisés après 12 h de jeûne pour éviter les écarts dus aux repas; néanmoins,
il apparaît aujourd'hui que les patients à risque ont un taux post-pandrial de
TG plus important, même si leur bilan lipidique à jeun est correct. La lipémie
post-pandriale est un facteur athérogène très important qu'il convient de
prendre en compte dans la détection du risque cardio-vasculaire. L'étude de la lipémie post-pandriale démontre un ralentissement du
catabolisme des lipoprotéines chez les sujets coronariens, lié à un taux plus
important de triglycérides et un taux moins important de HDL.
Chez l'homme, il n'existe pas de mécanisme
de contrôle de l'absorption des lipides.
Chez le sujet normal, le pic de
triglycérides dure 4 à 6 heures avec retour basal à la 8ème heure.
Des médicaments comme le fénofibrate ou le
lipanthyl permettent de régulariser la lipémie post-pandriale chez des patients
diabétiques
|
|
Taux glycémique limite |
|
à jeun |
entre 0.70 et 1.10 g/litre |
|
après un repas |
< à 1.40 g/litre |
|
2 h après un repas |
£ 0.60 g/litre |
Le
risque diabétique
Le diabète insulino-dépendant est une maladie due
à l’insuffisance d’insuline.
Le diabète non
insulino-dépendant est une maladie due à l’insensibilité relative des cellules
de tout l’organisme à l’insuline. Quelque soit l'âge du patient, l'espérance de
vie est réduite d'environ 30%. On note la relation
hyperinsulinisme-hypertriglycéridémie.
La goutte est une pathologie
conséquence d'une hyperlipoprotéinémie associée à un excès de goutte.
Le syndrome X associe obésité
androïde, hypertension, dyslipidémie, diabète, athérosclérose et perturbations
de l'hémostase.
Les diabétiques présentent un
risque accru de maladies cardio-vasculaires, 4 à 5 fois supérieur à celui des
sujets sains; la fréquence des AVC et des angiopathies est multipliée par 2 à
3, celle des infarctus du myocarde par 2 celle des artériopathies par 4 et
celle des gangrènes par 20.
Les diabétiques à 17% pour les
hommes et à 18% pour les femmes font un infarctus, en outre la mortalité de
l'infarctus est le double de celle des non diabétiques.
Le risque de décès
cardio-vasculaire est de 3.3% pour
L'artériopathie oblitérante est
présente dans 40% des cas après 20 ans d'évolution.
L'HTA est présente dans 50% des
cas.
L'augmentation d'acide urique entraîne
des modifications artérielles précoces dont les conséquences sont souvent
graves. Un taux supérieur à 7.1 mg/100 ml chez l'homme ou 6.1 mg/100 ml chez la
femme nécessite un traitement. Les personnes qui souffrent de ce type de
trouble meurent le plus souvent d'AVC ou d'infarctus. Le taux d'acide urique
est diminué par l'entraînement aérobie à raison de 5 séances par semaine. On
maintiendra un taux bas par 2 séances hebdomadaires de 45 minutes.
L'hyperuricémie est souvent associée aux
troubles du métabolisme des lipides (goutte).
Il varie de 0.20 à 0.50 g/l
< 2.2 mmol (88 mg) hypokaliémie
> 2.6 mmol (105 mg) hyperkaliémie
Taux plasmatique correct = 20 mg/l
Taux correct à 1.1 g/l
Taux correct à 0.3 g/l
Taux correct à 0.9 g/l
Il doit être inférieur à 12 mg/l et
caractérise le fonctionnement rénal.
Le taux normal est de
< 30 mg/24h
microalbuminurie entre 30 et 300 mg
macroalbuminurie > 300 mg
Dosage à effectuer en cas de suspicion
d'hypercholestérolémie secondaire à l'hypothyroïdie. Une hypothyroïdie primaire
entraîne des conséquences plus sévères qu'une hypothyroïdie secondaire à un
dysfonctionnement hypophysaire. En règle général, un bilan hormonal complet est
souhaitable car des hypersécrétions hormonales peuvent induire un dérèglement
réflexe du métabolisme lipidique.
Les taux de globules blancs de l'hématocrite
sont des facteurs de risque indépendants augmentés par le tabagisme.
Trois facteurs de coagulation dont le
fibrinogène sont également identifiés comme facteurs indépendants de risque
cardio-vasculaire.
L'addition des facteurs de risque
L'association de différents facteurs de
risque multiplie le risque final d'événement cardio-vasculaire.
 Taux de mortalité cardio-vasculaire corrigés
par l'âge pour 10000 personnes en fonction de la capacité physique et des taux
des facteurs de risque
Taux de mortalité cardio-vasculaire corrigés
par l'âge pour 10000 personnes en fonction de la capacité physique et des taux
des facteurs de risque
capacité
Nb FR faible moyenne élevée
0 22.8 4.2 3.6
1 23.9 10.2 6.5
2 46.2 22.5 13.2
3 51.1 27.5 12.6
FR = fumeur habituel
PAS
>140 mmHg
cholestérol
> 240 mg/dl

Mode de calcul du risque cardio-vasculaire
additionner TOTAL 1 et TOTAL 2
|
Résultats du questionnaire cardio-vasculaire |
||
|
Stade |
Points |
Nature du risque d'accident cardio-vasculaire |
|
Stade 1 |
6 à 11 |
très faible |
|
Stade 2 |
12 à 17 |
faible |
|
Stade 3 |
18 à 24 |
réel mais encore peu inquiétant |
|
Stade 4 |
25 à 31 |
très net, il faut faire attention |
|
Stade 5 |
32 à 40 |
grand, consultation médicale souhaitable |
|
Stade 6 |
41 à 62 |
très important, consultation médicale indispensable |
Les symptômes des pathologies
cardio-vasculaires
|
Pathologies |
Siège + irradiations |
Type |
Intensité |
Circonstances de survenue |
Augmentée par |
Diminuée par |
Durée |
|
Angor |
Rétrosternale large + maxillaire inférieur + bras gauche |
Constriction Brûlure |
Variable |
Effort Parfois la nuit |
Effort |
Repos Trinitrine |
Quelques minutes |
|
Infarctus du myocarde |
idem |
idem |
Très forte Parfois paroxy-stique |
Nocturne Brutale |
|
|
Quelques heures |
|
Péricardite aiguë |
Rétrosternale large + trapèzes |
Oppression |
Variable |
Contexte grippal |
Inspiration |
Penché en avant |
Quelques jours |
|
Dissection aortique |
Rétrosternale + dos |
Coup de poignard |
Forte |
Brutale |
|
|
Quelques heures |
|
Embolie pulmonaire et pathologies pleurales |
Latéro-thoracique |
Point de côté |
Variable |
Brutale +dyspnée |
Forts mouve-ments ventilatoires |
Faibles mouvements ventilatoires |
Quelques heures |
Environ 30% des premières manifestations de
la maladie coronaire prennent la forme de douleurs thoraciques appelées angine
de poitrine. La douleur et l’inconfort qui en résultent sont généralement
ressentis dans la partie supérieur du thorax, bien qu’ils soient fréquemment
caractérisés par un sensation de pression et de serrement dans l’épaule gauche,
le cou, la joue ou le bras gauche. Plusieurs rapportent aussi des sensations de
suffocation pendant un épisode angineux. En plus de la douleur, le travail du
cœur est aussi altéré. La diminution de la fonction du myocarde s’accompagne
d’une réduction du débit cardiaque, du volume d’éjection systolique et d‘une
diminution de la contractilité du ventricule gauche. Après quelques minutes de
repos, la douleur disparaît généralement sans que le cœur ne subisse de lésion
permanente.
Il s'agit d'une gêne respiratoire de type
polypnée (accélération du rythme respiratoire) ou bradypnée (ralentissement du
rythme).
l Tachycardie (accélération)
l Bradycardie (ralentissement)
l Arythmies (rythme irrégulier à fréquences hautes ou
basses)
l Extrasystoles (à-coups thoraciques irradiant
jusqu'au cou)
Seuls les
patients ayant une fraction d'éjection inférieure à 40% et des arythmies
ventriculaires complexes présentent un risque de mort subite dans les six mois
après infarctus du myocarde. Seuls 15 à 25% des adultes de plus de 35 ans
présentent statistiquement des risques potentiels.
Chez les sujets
jeunes la mortalité est 5 fois plus grande pour les hommes que pour les femmes.
95% des patients
décédés de mort subite pendant un effort sportif (sont compris les décès
suivant immédiatement l'effort) étaient porteurs d'une affection cardiaque dont
66% de cardiomyopathies hypertrophiques et hypertrophies idiopathiques dans le
groupe d'âge inférieur à 35 ans et 80% de maladies coronariennes dans le groupe
d'âge supérieur à 35 ans.
Les tachycardies
et fibrillations ventriculaires sont les principaux agents de la mort subite
pendant l'effort physique.
Le risque de
décès augmente en fonction de la participation des mécanismes anaérobies à
l'exercice, qui augmentent considérablement le taux de catécholamines et la
pression artérielle. Ce type d'exercice est strictement contre-indiqué chez les
porteurs d'une affection cardiaque.

Description des pathologies
cardio-vasculaires
La désadaptation à l'effort (DE) est le
paramètre commun à la plupart des patients d'un programme de réentraînement à
l'effort (RE). Cette DE touche tous les patients qui restent alités du fait de
leur pathologie, et tous ceux qui limitent leur dépense physique pour s'adapter
à leur pathologie chronique (asthmatiques, BCPO, cardiaques etc...). Dans ce
dernier cas la DE devient une pathologie secondaire aggravante de la pathologie
primaire. Le RE permettra une amélioration de la pathologie secondaire et la
réinsertion sociale du patient.
Il y a cent ans 90% de l'énergie du travail
produit provenait de la force musculaire; actuellement seulement 1% de cette
énergie provient du travail musculaire, d'où les problèmes modernes de
désadaptation liés à la sédentarité.
þ
Après 3 semaines de lit, le volume cardiaque radiologique diminue de 17%, FC
augmente de 10 bpm. A effort égal après 30 mn de marche FC est supérieur de 40
bpm, soit une perte quotidienne de 1% des fonctions physiologiques.
þ
Avec 20 jours de lit et 50 jours d'entraînement physique intense, VO2 Max passe
de 3.30 l/min à 2.43 et à 3.91. FC passe de 129 à 154 et à 120.
þ Diminution de la VO2 Max de 6 à 7% après
1 semaine d'alitement et 27% en 3 semaines et plus de 50% en 4 semaines;
þ Perte jusqu'à 20% de la force musculaire en une
semaine; le catabolisme protidique est majoré par l'anesthésie;
þ Augmentation du bilan azoté négatif de 1 à 3.5
mg/jour traduisant la fonte musculaire;
þ Chute du volume d'éjection systolique de 17%;
þ Diminution importante des capacités d'endurance ne
permettant souvent plus de faire face aux exigences de la vie courante. Dans le
DE l'endurance semble diminuer plus vite que la puissance aérobie;
þ Le volume plasmatique baisse de 10% en 4 jours, 15%
en 20 jours, majoré par l'effet des diurétiques en pathologie cardiaque ce qui
explique une diminution du débit cardiaque et de la tension artérielle;
þ Augmentation de la Fc de repos de 15% (0.5 bats/min
par jour d'alitement);
þ Si l'entraînement multiplie jusqu'à 3 le contenu
musculaire en enzymes oxydatives, l'inactivité complète peut le réduire jusqu'à
75% du niveau "non entraîné";
þ Augmentation du seuil d'accumulation des lactates;
þ Enraidissement des articulations, rétractation des
muscles. Il faut 55 jours d'entraînement physique intense pour récupérer les
déficits induits par 20 jours de repos au lit. Les dégâts supportés par les
ligaments et tendons après 8 semaines d'immobilisation, ne sont pas
complètement restaurés après 20 semaines d'exercice;
þ Une déminéralisation squelettique du fait de
l'absence de forces gravitaires et l'absence de forces de tractions musculaires
survient après 4 semaines d'alitement;
þ Le retour veineux diminue du fait de l'inactivité
musculaire et de l'absence de compression de la voûte plantaire;
þ La vitesse du flux veineux est diminuée, la
viscosité circulatoire augmente, aggravant le risque de thromboses veineuses
profondes (TVP) et embolies pulmonaires (EP);
þ
La compression abdominale des patients obèses en position assise bloque le
retour veineux et aggrave le risque de TVP;
þ 58% des embolies pulmonaires touchent un patient
alité;
þ 95% des TVP surviennent au niveau des membres
inférieurs et du bassin;
la prévention
des TVP et EP comprend la surélévation des pieds du lit de 15° (contre-indiqué
chez les artéritiques), la contention élastique, la mobilisation précoce, la
respiration thoracique, le lever précoce, la pressothérapie et
l'électrothérapie (contre-indiquées en présence de caillot sanguin);
þ Un dérèglement de l'adaptation à l'orthostatisme
peut survenir
l par effondrement du volume sanguin lors de la
verticalisation, avec piégeage du sang dans les extrémités des membres;
l diminution de l'a -stimulation
vasoconstrictrice;
l augmentation de la b -stimulation vasodilatatrice;
l augmentation de la filtration capillaire avec fuite
de liquide plasmatique dans les tissus extracellulaires;
l diminution de la sensibilité des barorécepteurs
carotidiens et aortiques entraînant une baisse tensionnelle et une chute du
débit cardiaque avec tendance à la syncope par perfusion insuffisante du
cerveau (TAS < 80 mmHg et volume plasmatique diminué de 13 à 15%);
þ La prévention se fait par:
l contention élastique des membres inférieurs;
l progression lors du lever;
l marche précoce;
þ Chez la personne âgée le DE dépend à 50% du
vieillissement et à 50% de la réduction des activités physiques. Tous les
systèmes organiques diminuent de 0.75 à 1% par an à partir de 30 ans. La force
musculaire diminue de 1% par année d'âge entre 44 et 55 ans, de 1.5 à 2% entre
56 et 65 ans et de plus de 2% après 65 ans. La VO2 Max diminue de
0.5% par année d'âge chez les actifs et de 0.9% chez les sédentaires. Le
système cardio-vasculaire et le système respiratoire sont altérés par la
sénescence et de façon plus marquée pour les sédentaires. Les déficiences
ostéo-articulaires du fait de l'ostéoporose (fragilisation de 0.75 à 1% par an
chez la femme dès 35 ans, et chez l'homme dès 55 ans) , de l'arthrose, des
altérations du collagène diminuant l'élasticité des tendons et ligaments, voire
de l'artérite sont à l'origine du DE de la personne âgée.
dominées par la phlébite qui est une
thrombose (obturation d'une veine par un caillot sanguin);
dominées par les varices qu’il vaudrait
mieux appeler insuffisance veineuse chronique. Cette maladie fréquente, dont
l'étiologie est dominée par l'âge et l'obésité chez l'homme, par l'âge, le
nombre de grossesses et l'obésité chez la femme, se traduit par la dilatation
permanente des veines superficielles des membres inférieurs avec deux
conséquences:
G un inconvénient médical avec trois risques:
(phlébite variqueuse, ulcère variqueux, rupture externe avec hémorragie)
G un inconvénient esthétique auquel les femmes sont
très sensibles.
Manifestations
cliniques liées à l'insuffisance veineuse chez les obèses
La surcharge pondérale comporte des
anomalies de la circulation veineuse. L'épaississement du panicule adipeux, met
en tension les tissus cutanés et éloigne la peau de l'aponévrose, étirant ainsi
progressivement le réseau veineux intermédiaire entre le réseau sous-cutané et
les troncs superficiels sus ou intra-aponévrotiques, saphène interne et saphène
externe. La distension des lobules participe à ce mécanisme et l'aggrave en
compressant le réseau vasculaire et lymphatique jusqu'à empêcher localement
tout échange circulatoire intermédiaire (cellulite froide). L'augmentation du
risque variqueux du fait de l'obésité existe mais reste insignifiant, passant
de 47% à 58% chez les hommes et de 54 à 59% chez les femmes; il est par contre
indéniable que l'obésité aggrave l'évolution de la maladie variqueuse:
- 25% si la surcharge est inférieure de
- 39% si la surcharge est comprise entre 20
et
- 59% si la surcharge est comprise entre 40
et
Un BMI de 27 pour la femme est considéré
comme seuil du risque maximum d'apparition de varices.
L'obésité (essentiellement gynoïde) est un
facteur de risque d'ulcères veineux et de thrombose veineux et est un facteur
aggravant des séquelles de phlébite
|
Poids idéal |
Indice de risque |
|
- 5 à + 2% |
18 |
|
+ 2 à + 10% |
41 |
|
+ 10 à + 20% |
37 |
|
> + 20% |
54 |
Si il n'y a pas de corrélation étiologique
entre la maladie variqueuse et la maladie coronaire, l'identité commune de
leurs facteurs de risque donne à la maladie variqueuse un rôle de marqueur
autonome de la maladie coronaire.
Physiopathologie
du retour veineux
L'obésité s'accompagne d'un certain nombre
de mécanismes entravant la circulation de retour:
- la réduction de l'activité et notamment de
la marche
- l'installation d'arthroses et de troubles
ostéo-ligamentaires aggravant l'inactivité
- l'affaissement de la voûte plantaire
entravant la communication entre réseau plantaire superficiel et réseau
plantaire profond.
- hypotonie musculaire
- fréquemment des problèmes respiratoires ,
l'augmentation du volume abdominal gênant le fonctionnement diaphragmatique
- éventuellement des perturbations
cardiaques du fait
-
d'une hypoxie permanente induisant une hypertension pulmonaire et une
insuffisance
ventriculaire droite
-
une insuffisance ventriculaire gauche du fait d'une HTA ou une
insuffisance
coronarienne
-
une atteinte myocardique secondaire à une infiltration graisseuse peut-
être
à l'origine de blocs auriculo-ventriculaires (BAV)
L'épaississement du panicule adipeux en
étirant le réseau veineux induisent des modifications physiologiques:
-
diminution de la vitesse du flux sanguin
-
augmentation de la pression sanguine
D'autre part le développement des masses
adipeuses réduit l'efficacité des contractions musculaires sur le retour
veineux et aggrave la stase veineuse. Des dilatations apparaissent dans la zone
de faiblesse de la veine et au niveau des valvules. Surviennent ensuite les
lésions tissulaires. Les phénomènes de stase et l'altération pariétale sont les
principaux éléments du développement d'une thrombose veineuse.
Influence
et dangers de l'amaigrissement
Si la diminution de la surcharge adipeuse
est souhaitable dans les cas d'obésité, cet diminution doit intervenir de
manière lente et progressive. En effet une perte rapide de poids augmente la
distensibilité veineuse des membres inférieurs; un régime hypocalorique
provoque une altération du métabolisme du collagène et de l'élastine de la
paroi veineuse du fait de la déficience en vitamines (E) et en oligo-éléments
(fer, cuivre).
 Les insuffisances lymphatiques
Les insuffisances lymphatiques
L'obésité engendre des problèmes du système
lymphatique similaires à ceux du système veineux. La distension des lobules
graisseux étire les espaces pré-lymphatiques et les vaisseaux lymphatiques,
comprime le réseau lymphatique engendrant ralentissement et blocage des
échanges.
- le lipœdème des jambes: infiltrations
graisseuses élastiques avec douleurs, nodules, limité à la partie inférieure du
corps, notamment sur la face interne des jambes, de couleur cyanosée constitué
par le cycle suivant:
-
œdème interstitiel avec hyperplasie
adipocytaire
-
apparition de fibres de réticuline créant des bandes de sclérose hyalines
enserrant les adipocytes
-
formation de micronodules
-
formation de macronodules
- les lipodystrophies ne présentent pas
d'œdèmes fibreux
-
forme localisée à la partie inférieure du mollet et à la cheville
-
forme globale dite jambe en poteau
Le diabète se définit par une glycémie à
jeun supérieure à 1.40 g/l à deux reprises ou une glycémie post-pandriale
supérieure à 2 g/l. Une glycémie à jeun comprise entre 1.10 et 1.40 g/l
associée à des antécédents familiaux de diabète ou/et des risques
cardio-vasculaires impose un traitement de normalisation de
Diabète
de type I insulino-dépendant (DID)
 Il représente 15% des cas de diabète en France. Ce diabète maigre et
juvénile correspond à une réaction auto-immune d'étiologie imprécise,
détruisant les îlots de Langerhans. Il engendre une carence insulinique, ne
permettant pas l'absorption du glucose par la cellule.
Il représente 15% des cas de diabète en France. Ce diabète maigre et
juvénile correspond à une réaction auto-immune d'étiologie imprécise,
détruisant les îlots de Langerhans. Il engendre une carence insulinique, ne
permettant pas l'absorption du glucose par la cellule.
Le DID est traité par injections d'insuline,
souvent effectuées par le patient lui-même à l'aide d'un stylo injectable et de
doses d'insuline dont le délai d'absorption est adapté aux caractéristiques de
la pathologie.
L'alimentation du patient DID est
normocalorique, pauvre en aliments à index glycémique élevé.
Diabète de type II non insulino-dépendant (DNID)
 Il représente 85% des cas de diabète en France. Ce type de diabète,
gras, touche l'adulte, souvent à maturité, et est associé à une obésité ou/et
une surcharge pondérale ayant développé une insulino-résistance et un hyper
insulinisme réflexe inefficace.
Il représente 85% des cas de diabète en France. Ce type de diabète,
gras, touche l'adulte, souvent à maturité, et est associé à une obésité ou/et
une surcharge pondérale ayant développé une insulino-résistance et un hyper
insulinisme réflexe inefficace.
L'obésité est défini par un Body Mass Index
(BMI) supérieur à 27 chez l'homme et à 25 chez la femme.
Le traitement du DNID fait appel à une
diététique hypocalorique équilibrée avec peu d'aliments à index glycémique
élevé, de l'activité physique aérobie, et un traitement médicamenteux à base d'anti-diabétiques
oraux.
Autres diabètes
- diabète insulino-requérant de type II
- diabète d'origine endocrinienne (Cushing,
acromégalie…)
- diabète iatrogène (corticothérapie)
- diabète d'origine pancréatique
(pancréatite chronique)


 La dégénérescence du revêtement interne des artères cardiaques (intima)
entraîne ischémie, occlusion progressive par la graisse calcifiée, coagulation
du sang circulant.
La dégénérescence du revêtement interne des artères cardiaques (intima)
entraîne ischémie, occlusion progressive par la graisse calcifiée, coagulation
du sang circulant.
Cette plaque se constitue progressivement
par accumulation de complexe lipoprotéiques, de tissus fibreux, de dépôts
calcaires, de produits dérivés du sang, de cellules inflammatoires, le tout
accompagné de modifications de
Les complications engendrées par la plaque
d'athérome sont:
-
l'obstruction coronaire ou sténose
-
la rupture engendrant la constitution d'un thrombus à la surface intimale
- l'hémorragie
- l'embolie

 La plaque d'athérosclérose est vulnérable. Le risque majeur est sa
fissuration ou/et sa rupture. Des facteurs favorisants (contenu de la plaque,
contenant de la plaque, inflammation) et des facteurs précipitants (contraintes
biomécaniques, hémorragies intra-plaques, pulsaltilité du réseau artériel…)
sont à la base de ce risque. La plaque dont le risque de rupture est le plus
élevé est une plaque peu sténosante, avec un composant lipidique important (³ 40% de la
surface de la plaque), une capsule fibreuse individualisée de faible épaisseur,
développée sur une artère de grand diamètre. Le facteur inflammatoire joue un
rôle décisif dans la rupture de la plaque.
La plaque d'athérosclérose est vulnérable. Le risque majeur est sa
fissuration ou/et sa rupture. Des facteurs favorisants (contenu de la plaque,
contenant de la plaque, inflammation) et des facteurs précipitants (contraintes
biomécaniques, hémorragies intra-plaques, pulsaltilité du réseau artériel…)
sont à la base de ce risque. La plaque dont le risque de rupture est le plus
élevé est une plaque peu sténosante, avec un composant lipidique important (³ 40% de la
surface de la plaque), une capsule fibreuse individualisée de faible épaisseur,
développée sur une artère de grand diamètre. Le facteur inflammatoire joue un
rôle décisif dans la rupture de la plaque.
La vulnérabilité d'une plaque est
difficilement quantifiable, car son évolution est imprécise.
 L'augmentation du tonus vasoconstricteur ou l'augmentation de la
pression endoluminale du fait d'un tonus sympathique très élevé entraînant un
stress pariétal déclenchant la rupture, des mécanismes inflammatoires avec
présence de C-réactine protéine (CRP) fréquemment retrouvée dans les cas
d'angor, une hémorragie locale intra-plaque sont des facteurs favorisant la
rupture d'une plaque d'athérome.
L'augmentation du tonus vasoconstricteur ou l'augmentation de la
pression endoluminale du fait d'un tonus sympathique très élevé entraînant un
stress pariétal déclenchant la rupture, des mécanismes inflammatoires avec
présence de C-réactine protéine (CRP) fréquemment retrouvée dans les cas
d'angor, une hémorragie locale intra-plaque sont des facteurs favorisant la
rupture d'une plaque d'athérome.






La maladie athéromateuse ou maladie du
système artériel possède:
®
3 localisations dominantes: le cœur, les membres inférieurs, le cerveau.
® 8 facteurs de risque :
- 2 facteurs
cliniques: le surpoids et l’hypertension artérielle
- 3 facteurs de
comportement: la sédentarité, l’alcoolisme, le tabagisme
- 3 facteurs
biologiques: l'excès de glucose, l'excès de lipides (cholestérol et/ou
triglycérides), l'excès d’acide urique.

Sur le plan lésionnel, il y a 2 stades successifs:
l’angor est une obstruction partielle d’une artère: à
l’effort, le cœur travaillant davantage ne reçoit pas tout l’oxygène dont il a
besoin d’où souffrance des cellules et douleur intense; après quelques minutes
de repos, la situation se rétablit par moindre besoin d’oxygène. A l’occasion
d’un effort soit important soit réalisé dans certaines conditions (froid, vent
contraire, après un repas) apparaît une douleur médio-thoracique ou dans un
bras, plus ou moins violente allant de la simple sensation de pesanteur à une
sensation de striction interne très pénible. Il est souvent noté une douleur
extrême du type de striction, angoisse extrême, sensation de mort imminente;
cette douleur disparaît souvent spontanément, surtout par la cessation de l’effort;
l’épisode douloureux peut être oublié chez le sportif d’où la nécessité pour le
médecin d’un interrogatoire soigneux.
L’infarctus est une obstruction totale d’une artère par un
thrombus: à l’effort ou au repos, un certain territoire cardiaque est privé
totalement de l’oxygène indispensable d’où mort des cellules de ce territoire,
douleur extrême et risque de mort; une réanimation en milieu spécialisé est
indispensable. La rupture de la plaque entraîne la formation d'un caillot ou
thrombus qui peut gêner l'écoulement du sang, se fragmenter et migrer
provoquant des embolies, ou occlure l'artère et créer une ischémie pouvant
engendrer une nécrose (infarctus).
 Habituellement les lésions atteignent l'aorte abdominale, puis les
artères coronaires, les artères iliaques, et enfin les artères du cerveau.
Actuellement sans explication, ne sont pas touchées par l'athérosclérose les
artères mammaires, les artères axillaires, les carotides externes.
L'athérosclérose n'existe que dans les conduits exposés à une pression élevée
de type artériel systémique.
Habituellement les lésions atteignent l'aorte abdominale, puis les
artères coronaires, les artères iliaques, et enfin les artères du cerveau.
Actuellement sans explication, ne sont pas touchées par l'athérosclérose les
artères mammaires, les artères axillaires, les carotides externes.
L'athérosclérose n'existe que dans les conduits exposés à une pression élevée
de type artériel systémique.
Atteinte athéromateuse des
artères du membre inférieur :
L’artérite
chronique oblitérante du membre inférieur est l’obstruction d’une ou de
plusieurs artères de la jambe avec claudication intermittente due au manque
d’oxygène dans le mollet ou obstruction plus importante avec gangrène.
Gravité clinique de l'artériopathie des membres
inférieurs
Classification de Leriche
Stade 1 absence de symptomatologie fonctionnelle, mais abolition de
un ou plusieurs pouls
Stade 2 claudication intermittente à l'effort
A:
faible, périmètre de marche >
B:
fort, périmètre de marche <
Stade 3 douleurs de décubitus
Stade 4 troubles trophiques, voire gangrène
 Atteinte athéromateuse des artères du cerveau
Atteinte athéromateuse des artères du cerveau
Elle entraîne des
conséquences variables: de la petite déficience sensitivo-motrice à la mort
immédiate.
Atteinte des petites
artères et des artérioles
Elle se rencontre surtout dans le diabète
avec 2 localisations préférentielles
® l’atteinte des artérioles du rein aboutissant à
l’insuffisance rénale chronique
® l'atteinte des artérioles de la rétine aboutissant à
la cécité.
Les
accidents vasculaires cérébraux (AVC)
Le taux de décès s'élève à 25% au terme du 1er
mois et à 40% au bout d'un an. Ils touchent à 88% des personnes de plus de 65
ans. Les décès sont souvent occasionnés par une fibrillation auriculaire (5 à
10%) ou une insuffisance cardiaque (25 à 50%). Les thromboses veineuses
touchent 40% des hémiplégiques dans les 6 premiers mois après l'AVC et
entraînent pour 10 à 15% des embolies pulmonaires. La fréquence des thromboses
veineuses profondes est 7.5 fois plus importante du côté paralysé chez un
hémiplégique
Plus de 70% des AVC sont d'origine
ischémiques par embolie ou le plus souvent par thrombose de petits vaisseaux
secondaires à l'hypertrophie vasculaire.
L'accident vasculaire
cérébral hémorragique (20%)

L'accident ischémique cérébral
du à l'athérosclérose (50%)
Il est du au
développement , sur une sténose athéroscléreuse, d'une thrombose qui peut
entraîner une occlusion de l'artère ou une embolie. Ces patients ont un risque
élevé de récidive ischémique cérébrale, mais aussi d'infarctus du myocarde ou
autre cause vasculaire de décès. La chirurgie carotidienne est nécessitée par
une sténose supérieure à 70%

L'accident ischémique transitoire
(AIT)
Environ 20% des
accidents ischémiques cérébraux sont précédés par des accidents ischémiques
transitoires. Il s'agit d'un dysfonctionnement focal cérébral ou oculaire
régressant complètement sans séquelle. L'AIT dure moins de 24 h, 60% durent moins
d'une heure et 25% moins de 5 minutes. L'AIT est à 60% d'origine athéromateuse
et à 20% d'origine cardio-embolique. 8% des AIT ont pour conséquence un
infarctus cérébral dans les 3 mois suivant. L'AIT passe souvent inaperçu, il
faut rechercher une baisse de l'acuité visuelle (artère ophtalmique), des
troubles du langage et des troubles sensitivo-moteurs prédominant dans la
région brachio-faciale et unilatéraux (territoire sylvien), des troubles de
l'équilibre, visuels et sensitivo-moteurs (territoire vertébro-basilaire).
Environ 40% des
patients examinés pour un AIT ou constitué ont développé une sténose
athéromateuse carotidienne interne de plus de 35%. Dans la moitié des cas la
sténose dépasse 75%. Le risque de récidive dans le même territoire est d'environ
10% par an. Les lésions carotidiennes athéromateuses progressent moins chez les
sujets ayant arrêté de fumer que chez ceux dont l'intoxication se poursuit.
L'accident ischémique
cérébral cardio-embolique (15-20%)
Il est la
conséquence d'une embolie provenant du cœur.
-
cardiopathie à haut risque emboligène: valvulopathies rhumatismales,
prothèses
valvulaires, fibrillation auriculaire, cardiomyopathies dilatées)
-
cardiopathie mineure
Ces infarctus cérébraux comportent un risque
élevé de récidive embolique
précoce (de 5 à12% dans les 15 jours suivant
l'accident). 1 à 5% des patients
ayant fait un infarctus du myocarde
présenteront par la suite un AVC
ischémique.
L'accident ischémique cérébral du à la lipohyalinose
(15 – 20%)
Il s'agit d'une
maladie des petites artères cérébrales associée à une hypertension artérielle
chronique ou à un diabète qui provoque des petits infarctus lacunaires (moins
de


|
Survie dans l'insuffisance cardiaque (étude Framingham (1948-1988) |
||
|
|
HOMME |
FEMME |
|
à 1 an |
57% |
25% |
|
à 5 ans |
25% |
38% |
Il s'agit d'un syndrome traduisant
l'incapacité du cœur à faire face aux besoins circulatoires de l'organisme. La
mortalité est largement supérieure à 50% dans les 5 ans.
Pour une insuffisance VG à 35% la survie
atteint 80% à 7 ans si la performance est > 7 METS, et moins de 50% si <
à 4 METS.
L'insuffisance respiratoire et
l'hyperthyroïdie et surtout l'HTA et les cardiopathies ischémiques sont les
principales causes de l'insuffisance cardiaque. Elle se caractérise par des
modifications structurales et fonctionnelles des artères et du cœur:
-
épaississement des parois artérielles
-
augmentation du rapport média/lumière
-
diminution de compliance des gros troncs
-
augmentation des résistances artériolaires
-
dysfonctionnement endothélial
-
augmentation et remodelage du myocarde
-
hypertrophie ventriculaire gauche
L'insuffisance cardiaque contrôlée par la
thérapeutique est dite compensée; dans le cas contraire, elle est dite
décompensée.
Les décompensations dont les formes les plus
graves sont l'œdème aigu du poumon (OAP) et le choc cardiogénique apparaissent
de manière spontanée ou lors d'infections ou de troubles du rythme.
Le sujet est atteint de tachycardie, hypotension artérielle et montre des signes d'hypoperfusion périphérique (extrémités froides et cyanosées, diminution de la diurèse, diminution de la vigilance). Une désobstruction et une dilatation coronaire doivent être pratiquées en urgence
Œdème
aigu du poumon (OAP)
le sujet est atteint de fatigue, il respire vite, la toux d’abord sèche devient humide avec une expectoration spumeuse, rosée voire hémoptoïque; le cœur bat vite et la peau se cyanose. Traitement médical par diurétique.
L'insuffisance cardiaque sévère se
caractérise par une hyperactivité orthosympathique responsable d'une
vasoconstriction périphérique avec augmentation des résistances vasculaires
systémiques.
L'activité adrénergique en augmentant les
résistances vasculaires systémiques, (croissantes de
L'altération de la fonction ventriculaire
gauche provient essentiellement du défaut de cinétique de la plaque
d'infarctus, ou d'une déficience du myocarde par atteinte coronaire diffuse.
L'extraction d'O2 n'est pas
altérée chez les décompensés cardiaques. On note au contraire une amélioration
jusqu'à15-16 ml O2/100 ml de sang, afin de compenser l'impossibilité
d'élever le débit cardiaque (5000 ml/mn) dans les formes sévères, soit 750 ml
d'O2. Si le débit cardiaque chute à 1500 ml/mn, la VO2
sera de 225 ml et s'accompagnera d'une acidose métabolique.
L'insuffisance cardiaque amène un recours
d'autant plus précoce au métabolisme anaérobie que la fonction cardiaque est
altérée. L'augmentation précoce de la lactatémie pour des efforts de faible ou
moyenne intensité, voire au repos pour les patients les plus sévèrement
atteints puisque l'apport d'O2 n'est pas compensé par l'amélioration
de l'extraction en O2, entraîne une acidose métabolique,
l'augmentation précoce d'excrétion de CO2, de la ventilation minute
et la sensation de dyspnée dont se plaignent ces patients au moindre effort.
Chez les patients décompensés cardiaques
chroniques, l'espace mort physiologique de repos peut se situer au-dessus de la
normale, ce qui avec un petit volume courant donne un rapport Vd / Vt
important. Il y a donc un grand nombre d'unités alvéolaires ayant un rapport
ventilation / perfusion élevée. L'hypothèse la plus probable reste une
diminution de la perfusion de certaines régions suite à des modifications
hypertrophiques vasculaires ou à des thrombus. L'espace mort élevé explique la
ventilation minute élevée de ces patients qui doivent fournir un effort
respiratoire plus important. Pour un même débit de CO2 (VCO2)
VE s'accroît avec la sévérité de l'insuffisance. La ventilation pulmonaire est
rarement le facteur limitant de l'effort chez ces patients.
L'augmentation de la ventilation minute à
l'effort chez les IC se fait via l'augmentation de fr et Vt pour les classes A
et B et surtout par fr pour les classes C et D, augmentant proportionnellement
plus la ventilation de l'espace mort.
Vt Max = 50 ± 13% de la capacité vitale CV
pour
Vt Max = 42 ± 15% CV pour
Vt / CV dépasse rarement les 50%.
|
Classification |
VO2 Max rapportée au kg en ml/kg |
%augmentation possible de VES à l'effort en position debout |
Seuil de rupture VCO2 / VO2 ou seuil anaérobique |
|
Insuffisance cardio-vasculaire E |
£ 6 ml/min.kg |
0% |
< 4 ml/min.kg |
|
Insuffisance cardio-vasculaire D |
7 - 10 ml/min.kg |
0% |
5 - 8 ml/min.kg |
|
Insuffisance cardio-vasculaire C |
11 - 15 ml/min.kg |
25% |
8 - 11 ml/min.kg |
|
Insuffisance cardio-vasculaire B |
16 - 20 ml/min.kg |
45% |
11 - 14 ml/min.kg |
|
Insuffisance cardio-vasculaire A |
21 - 25 ml/min.kg |
50% |
> 14 ml/min.kg |
|
Sujet sain sédentaire |
26 - 30 ml/min.kg |
|
|
|
Sujet actif |
31 - 39 ml/min.kg |
|
|
|
Sujet entraîné |
40 - 59 ml/min.kg |
100% |
|
|
Sujet athlétique |
³ 60 ml/min.kg |
100% |
|
L'élévation de la pression artérielle à
l'effort est normale pour les classes A et B, mais atténuée pour C et D.
L'origine peut en être une HTA, une
valvulopathie, une myocardiopathie, et surtout une insuffisance du ventricule
gauche.
Le symptôme majeur en décompensation est:
Ø une polypnée d'effort évoluant vers une polypnée en
décubitus, et ensuite permanente,
Ø une tachycardie
Ø à l'auscultation des bruits cardiaques et
pulmonaires (présence de liquide)
Ø des troubles digestifs
La forme la plus grave de décompensation est
l'œdème aigu du poumon (OAP), souvent nocturne, avec toux incessante, mousse de
couleur rosâtre. Sans traitement rapide, ce tableau évolue vers la mort du
patient.
L'examen mettra en évidence l'hypertrophie
du ventricule gauche et la baisse du débit cardiaque. On peut diagnostiquer une
cardiopathie hypertrophique par:
Ø la découverte d'un souffle mésosystolique d'une
intensité maximale au niveau parasternal gauche qui s'intensifie en position
debout et durant la manœuvre de Valsalva
Ø un ECG anormal (hypertrophie, onde Q pathologique en
pointe, anomalies ST-T). Ces signes ne sont pas spécifiques de la seule
cardiopathie hypertrophique.
Ø le poids du cœur parce que le poids maximum d'un
cœur sain hypertrophié est de
L'insuffisance cardiaque gauche évolue le
plus fréquemment par périodes vers l'insuffisance cardiaque globale non
soignable, jusqu'au décès du patient par OAP, choc cardiogénique ou fibrillation
ventriculaire.
Chez les patients dont la fonction
ventriculaire gauche est altérée, l'effort isométrique élève la PA en élevant
d'avantage les résistances périphériques que le débit cardiaque (élévation
moindre de Fc). L'augmentation de PA peut induire une augmentation de la
pression télédiastolique entraînant une surcharge au niveau de la circulation
pulmonaire. Des efforts isométriques supérieurs à 20-25% de la contraction
maximale sont déconseillés chez ces patients.
Les œdèmes pulmonaires à répétition peuvent
entraîner une fibrose pulmonaire résiduelle.
L'origine peut en être une cardiopathie
droite (valvulopathie, dysplasie du VD ou infarctus du cœur droit), une maladie
pulmonaire aiguë (embolie pulmonaire) nommée "cœur pulmonaire aigu"
et le plus souvent une maladie respiratoire chronique entraînant une
hypertension pulmonaire ("cœur pulmonaire") et une insuffisance du
ventricule droit.
Les symptômes en phase de décompensation
sont:
Ø veines jugulaires turgescentes qui se gonflent lors
de la pression sur le foie (reflux hépato-jugulaire)
Ø foie gros et sensible, notamment à l'effort
Ø œdèmes mobiles sur les membres inférieurs du patient
debout, sur les lombes et sous les fesses du patient couché
L'insuffisance cardiaque droite se compense
quand la maladie respiratoire qui en est à l'origine est stabilisée. Quand
l'insuffisance est chronique, elle évolue par périodes vers une forme rebelle
au traitement, aggravée par des thromboses ou stases veineuses, des embolies pulmonaires
et des troubles du rythme cardiaque.
L'insuffisance cardiaque droite aiguë au
cours de l'embolie pulmonaire ou de l'infarctus myocardique du VD est
fréquemment mortelle.
Il s'agit d'une fausse pathologie ou d'un
examen faussement positif. Du fait de l'hypertrophie de son ventricule gauche
(HVG), le "gros cœur" ou "cœur d'athlète" a un comportement
ECG similaire à une hypertrophie pathologique du ventricule gauche. A La
différence du cas pathologique, le cœur d'athlète ne montre aucun signe
fonctionnel, et l'hypertrophie régresse, ainsi que les faux symptômes quand le
sujet arrête l'entraînement (en 3 à 6 mois).
Le cœur d'athlète ne se rencontre que sur
des sportifs pratiquant de manière intensive au moins 12 heures par semaine. Il
faut être très prudent dans ce cas, car nombre de morts subites de sportifs,
sont dues à des faux diagnostics de cœur d'athlète qui étaient en fait une
pathologie réelle. 75% des morts subites à l'effort avant 35 ans sont liées à
un processus hypertrophique pathologique.
L'hypertrophie
du ventricule gauche
 L'HVG est induite par différents facteurs: âge, surcharge pondérale,
facteurs neuro-hormonaux (hyperthyroïdie à 50%), facteurs génétiques. L'HVG est
une adaptation à la post-charge induite par
L'HVG est induite par différents facteurs: âge, surcharge pondérale,
facteurs neuro-hormonaux (hyperthyroïdie à 50%), facteurs génétiques. L'HVG est
une adaptation à la post-charge induite par
 L'HVG peut être concentrique quand l'épaississement du ventricule se
fait vers l'intérieur ou excentrique quand cet l'hypertrophie se fait vers
l'extérieur par augmentation de la cavité sans épaississement important de
L'HVG peut être concentrique quand l'épaississement du ventricule se
fait vers l'intérieur ou excentrique quand cet l'hypertrophie se fait vers
l'extérieur par augmentation de la cavité sans épaississement important de
F
Troubles du remplissage dus au retard du processus de relaxation. Le
remplissage est ralenti pendant la première période de la diastole et donc
accéléré pendant la seconde partie par une participation accrue de la systole
auriculaire. Il en résulte une dilatation de l'oreillette rendue plus sensible
aux arythmies et moins adaptive à la fibrillation.
F
Insuffisance coronaire gauche par hypertrophie ventriculaire avec excès de
collagène diminuant la compliance (fibrose), hypertrophie de la média des
artères coronaires et ESV. Le tissu sous-endocardique peut manquer d'oxygène
pris en priorité par le tissu superficiel mieux irrigué et déclencher un angor
alors que le réseau coronaire est sain.
F
Troubles du rythme cardiaque auriculaires ou ventriculaires
On peut détecter une HVG par l'ECG qui
montre une augmentation de l'amplitude des complexes QRS (dépolarisation du
ventricule gauche); cependant cette méthode n'est pas assez fiable et l'HVG
peut ne pas être détectée. L'échocardiographie qui permet la mesure de l'épaisseur
du VG, l'estimation du poids, la mesure du volume de la cavité est beaucoup
plus fiable que l'ECG pour détecter et caractériser l'HVG.
Les études échocardiographiques permettront
de déterminer l'HVG.
Insuffisance globale des deux ventricules
Elle caractérise une insuffisance cardiaque
gauche et droite. Sa forme la plus grave est le choc cardiogénique qui
nécessite un traitement d'urgence sous peine de mort.
Son origine est un infarctus myocardique
aigu, une embolie pulmonaire, une tachycardie ventriculaire, la phase terminale
des cardiopathies.
ses symptômes sont:
ü polypnée
ü soif
ü malaise général
ü peau froide, marbrée
ü chute tensionnelle
ü tachycardie importante
ü oligo-anurie
ü symptômes d'OAP
ü symptômes d'insuffisance cardiaque droite
Chez les décompensés cardiaques sévères et
œdémateux la capacité de vasodilatation artériolaire est réduite de 50%.
Le traitement des insuffisances cardiaques
Ø traitement de la pathologie d'origine
Ø traitement symptomatique
- repos
- régime sans
sel (
- diurétiques
(action sur les pressions de remplissage)
- tonicardiaques
- dérivés nitrés
(diminution de la pression capillaire)
- IEC
-
vasodilatateurs artériels (améliorent le débit cardiaque)
- éventuellement
correction chirurgicale ou greffe
- réadaptation
contre-indiquée en phase de décompensation
- légère
activité physique pour les petites insuffisances afin de conserver une
autonomie au patient
Ø traitement d'urgence de l'OAP
- dérivés nitrés
sublinguaux ou injectables d'action rapide (Natirose, Risordan, Natispray)
- diurétiques
d'action rapide (Lasilix)
- une saignée
rapide (300 cc)
Une valvulopathie peut être caractérisée
par:
Ø une fuite ou insuffisance valvulaire quand
l'appareil fermé n'est pas étanche, hypertrophiant les cavités cardiaques en
aval, notamment les ventricules et induisant une insuffisance cardiaque.
Ø un rétrécissement ou une sténose qui limite le
passage sanguin et dilate les cavités cardiaques en amont avec hyperpression et
hypertrophie. L'hypertrophie d'un ventricule conduira à l'insuffisance
cardiaque. En cas de rétrécissement important, peuvent survenir des accidents
graves voire mortels.
Ø une maladie de l'appareil valvulaire ou association
d'une fuite et d'un rétrécissement.
On remarque:
Ø les atteintes congénitales
Ø les atteintes acquises
d'origine
infectieuse (rhumatisme articulaire aigu de l'enfant, endocardite infectieuse
du fait d'une greffe)
dégénératives
ischémiques
(valves tricuspides et mitrales)
fonctionnelles
du fait des distensions imposées par les dilatations ventriculaires de
l'insuffisance cardiaque.
Les symptômes des valvulopathies mettent
souvent beaucoup de temps à apparaître. On remarque:
l une dyspnée d'effort dans toutes les valvulopathies
gauches
l un angor d'effort dans les valvulopathies aortiques
l des palpitations surtout dans les valvulopathies
mitrales
l des syncopes d'effort (entraînant parfois le décès)
dans les rétrécissements aortiques ou pulmonaires
l une cardiomégalie dans les formes les plus sévères
L'auscultation met en évidences des bruits
et des souffles anormaux.
La radiographie et le tracé ECG mettent en
évidence les hypertrophies des cavités.
Le phonocardiogramme et l'échocardiographie
servent également au diagnostic des valvulopathies.
Les rétrécissements valvulaires s'aggravent
et sont d'un mauvais pronostic, notamment en cas de rétrécissement aortique.
Les insuffisances valvulaires évoluent lentement vers une insuffisance
cardiaque. L'insuffisance valvulaire aiguë est symptomatique d'une insuffisance
cardiaque aiguë dans les ruptures d'un élément valvulaire. Le pronostic vital
est peu favorable quand le patient est arrivé à un degré important d'atteinte
fonctionnelle avec hypercardiomégalie.
Différents types de valvulopathies
Elle entraîne une gêne à l'écoulement du
sang, entraînant une surcharge de travail ventriculaire et une diminution du
débit aortique. Ses causes sont le rhumatisme articulaire aigu, ou souvent une
calcification chez le patient âgé.
Le pronostic vital est de 3 à 5 ans après
présentation des symptômes. Le pronostic postopératoire est en général très
favorable, la fraction d'éjection du ventricule gauche (FEVG) pouvant
s'améliorer spectaculairement en six mois et se normalisant complètement dans
50% des cas.
Elle laisse refluer le sang de l'aorte dans
le ventricule gauche qu'il vient de quitter au moment où le cœur se remplit. De
ce fait, elle impose une surcharge de travail ventriculaire conduisant à terme
à l'insuffisance ventriculaire. Ses cause principales sont le rhumatisme
articulaire aigu et les endocardites infectieuses.
Elle se signale plus tardivement, après
hypertrophie et insuffisance du VG. Le pronostic vital se situe aux alentours
de 9 ans.
L'augmentation nécessaire de la pression
auriculaire implique une augmentation de la pression pulmonaire entraînant
dyspnée, OPA, hypertrophie et insuffisance VD, insuffisance de la valve
tricuspide, œdèmes périphériques...La cause principale en est le RAA.
L'apparition des symptômes est plus tardive
et plus progressive que
Elle est le plus souvent associée à une
autre atteinte valvulaire (mitrale). Elle entraîne une importante dilatation de
l'oreillette droite et une insuffisance cardiaque droite avec œdèmes, congestion
hépatique etc...
Elle est le plus souvent consécutive à
l'hypertrophie de VD, conséquence d'un infarctus du VD ou d'une hypertension
pulmonaire. En l'absence d'HTA pulmonaire, l'IT est bien tolérée. En cas d'HTA
pulmonaire, le traitement chirurgical est proposé éventuellement après
correction de la pathologie primaire (mitrale), si l'IT persiste.
Le choix des prothèses valvulaires
Actuellement aucune prothèse valvulaire ne
peut prétendre répondre aux qualités d'une valve native normale. On distingue
deux sortes de valves:
Ë les valves mécaniques (bille, disque, clapet,) qui
présentent une grande longévité, mais nécessitent le recours aux
anticoagulants, sont bruyantes et pour certaines (billes) présentent une
hémolyse importante. Elles sont indiquées pour les patients de moins de 65 ans
non porteurs de contre-indication aux AC.
Ë les valves biologiques (valves de porc, tissu
péricardique) ne présentent pas les problèmes des valves mécaniques mais ont
une durée de vie beaucoup plus courte comprise entre 5 et 15 ans.
Le traitement des valvulopathies
Ë des mesures préventives
- par le
traitement antibiotique systématique des angines de l'enfant
- par la
recherche et le traitement systématiques des foyers infectieux dans les cas de
cardiopathie valvulaire ou congénitale.
Ë un traitement médicamenteux diurétique,
tonicardiaque, nitré, anticoagulant, antiarythmique...
Ë des dilatations valvulaires des rétrécissements à
l'aide de ballonnets gonflables
Ë un traitement chirurgical par réparation ou
remplacement des valvules:
- chez les enfants, il est préférable
d'utiliser la chirurgie même avec un résultat médiocre et d'attendre l'âge
adulte pour poser une prothèse;
- la
cardiomégalie développée dans les formes sévères régresse généralement après
chirurgie valvulaire;
- les bénéfices
d'un remplacement valvulaire sont envisageables si FEVG > 40%;
- les sténoses
sont d'un meilleur pronostic que les insuffisances. L'amélioration est plus
évidente, dans l'ordre, pour les remplacements de valve aortique, puis mitrale,
et ensuite le remplacement des deux valves qui présente la moins bonne
adaptation à l'effort.
Ë Le réentraînement à l'effort n'est utile que pour
contrer le syndrome de désadaptation à l'effort; il est contre-indiqué dans les
rétrécissements aortiques.
- liquidienne: la cavité péricardique contient un liquide
- sèche: l'inflammation ne s'accompagne pas d'un épanchement
- péricardite
aiguë bénigne idiopathique, sans étiologie
apparente et guérissant sans séquelles
Les symptômes sont:
- une douleur
progressive, rétrosternale, irradiant jusqu'au trapèze, augmentée par
l'inspiration et diminuée par la position penchée en avant
- un état de
fièvre (38 à
- un ECG présentant
initialement un sus-décalage curviligne de ST, puis un retour à la ligne
isoélectrique de ST et négativation de T, puis une normalisation du tracé en
quelques jours ou semaines
(au delà de trois mois)
- liquidienne: la tamponnade est la compression aiguë du cœur par
l'épanchement
-
constrictrice: fibroses, voire
calcifications très lentes (plusieurs années) du péricarde qui bloquent
l'expansion ventriculaire.
L'étiologie des péricardites est variable:
ü infections
ü cancers, métastases, radiothérapie
ü infarctus du myocarde
ü insuffisance rénale chronique
ü collagénoses
ü post-péricardotomie...
La péricardite guérit généralement en
quelques jours ou quelques semaines sans séquelles, avec quelques fois une
rechute.
L'évolution se complique en cas de
tamponnade, d'évolution chronique (au delà de trois mois) ou vers la
constriction.
L'entraînement physique doit être interrompu
jusqu'au contrôle complet de l'épanchement.
Le traitement comprend:
- repos au lit
puis à la chambre
- antalgiques et
AINS
- intervention
chirurgicale en cas de tamponnade ou de chronicité
Les péricardites de l'infarctus du myocarde
Elles sont fréquentes et peuvent être
confondues avec une reprise de la maladie coronarienne:
ð La forme précoce dans les premiers jours d'un infarctus voit réapparaître une douleur ou
un frottement péricardique.
ð La forme tardive ou syndrome de Dressler est une péricardite aiguë, associée parfois à
une pleurésie qui survient entre trois semaines et trois mois après l'infarctus.
Son traitement
comprend
ü arrêt du RE
ü repos
ü AINS
Il s'agit de l'obstruction brutale d'une ou
plusieurs branches artérielles pulmonaires, par un caillot sanguin d'origine
veineuse.
Ses causes peuvent être:
ð stase sanguine (alitement, faible débit cardiaque,
cancers...)
ð traumatisme vasculaire.
Les symptômes sont:
¨ polypnée
¨ tachycardie sinusale de fréquence 100 à 150
¨ parfois signes d'insuffisance cardiaque droite
¨ parfois signes de phlébite
¨ signes de surcharge ventriculaire droite mis en
évidence par l'ECG
¨ obstruction mise en évidence par l'angiographie
Le traitement de l'embolie se fait en deux
opérations:
ð Le traitement de l'embolie: l'embolie se guérit
généralement en quelques semaines sans séquelles, sous l'effet de la
fibrinolyse spontanée et des médicaments (antivitamines K, antiagrégants
plaquettaires, fibrinolytiques). Une oxygénothérapie continue au stade aigu est
souvent nécessaire, l'embolectomie chirurgicale restant exceptionnelle.
ð Le traitement du foyer emboligène: bénéficie du
traitement prescrit pour l'embolie. Une rechute aggravée, parfois mortelle peut
survenir en cas de traitement incomplet du foyer emboligène. On peut être amené
à mettre en place certaines protections mécaniques interdisant la migration de
nouveaux caillots sanguins (ombrelles, clamps...).
Deux équipes au Plessis Robinson (France) et
à San Diego (USA) ont mis au point une technique chirurgicale, la
thrombo-endartériectomie pulmonaire, pour éliminer les caillots et le tissu
fibreux de l'artère pulmonaire.
La prévention de l'embolie pulmonaire
associe
® lever précoce des patients alités
® contention élastique des membres inférieurs
® massages circulatoires
® électrothérapie et pressothérapie
® médicaments (héparine, calciparine, antivitamines K,
antiagrégants plaquettaires...)
L'hypertension artérielle est "sans
cause" dans 90% des cas et dite "secondaire" dans 10% des cas.
Les principaux facteurs physiopathologiques de l'HTA sont:
- coarctation aortique,
- rétrécissement de l'artère rénale,
- maladie rénale,
- insuffisances rénales,
- Caractère brutal de la survenue de HTA
-
HTA importante
-
Absence d'antécédents familiaux
-
Problèmes vasculaires
-
Dosage de la kaliémie (hyperaldostéronisme secondaire)
-
Dosage de la créatinine plasmatique
-
Recherche d'une protéinurie
-
Confirmation par echo-doppler, urographie, scintigraphie ou
surtout
angiographie numérisée par voie veineuse
- rétention anormale hydro-saline,
- anomalie du fonctionnement cellulaire au
niveau de la paroi vasculaire
- anomalie hormonale (notamment du système
rénine-angiotensine)
- anomalie du système nerveux sympathique
|
Fréquence de l'HTA selon l'âge et le sexe |
||
|
Age |
Hommes |
Femmes |
|
18-24 ans |
1.6% |
1.1% |
|
25-34 ans |
4.8% |
3.1% |
|
35-44 ans |
13.4% |
8.4% |
|
45-54 ans |
18.9% |
18.2% |
|
55-64 ans |
23.3% |
31.8% |
|
65-74 ans |
30.3% |
49.9% |
|
75-79 ans |
41.6% |
45.9% |
- tumeurs,
- diabète,
- surconsommation d'alcool ou de réglisse
L'héritage génétique est cause de 30% des
hypertensions artérielles. Ce caractère génétique a été retrouvé même dans des
environnements familiaux différents. L'environnement familial pèse entre 5 et
30% de la variabilité de PA.
|
Définition de l'HTA |
||||||||||||||||||||||||
|
Catégories |
PA systolique (mmHg) |
PA diastolique (mmHg) |
||||||||||||||||||||||
|
Normale |
< 130 |
< 85 |
||||||||||||||||||||||
|
Normale haute |
130-139 |
85-89 |
||||||||||||||||||||||
|
HTA stade 1 (légère) |
140-159 |
90-99 |
||||||||||||||||||||||
|
HTA stade 2 (modérée) |
160-179 |
100-109 |
||||||||||||||||||||||
|
HTA stade 3 (sévère) |
180-209 |
110-119 |
||||||||||||||||||||||
|
HTA stade 4 (très sévère) |
³ 210 |
³ 120 |
||||||||||||||||||||||
|
Tension artérielle en fonction de la taille (en mmHg) |
||||||||||||||||||||||||
|
cm |
TA médiane |
HTA limite |
HTA confirmée |
HTA dangereuse |
||||||||||||||||||||
|
|
Systole |
Diastole |
Systole |
Diastole |
Systole |
Diastole |
Systole |
Diastole |
||||||||||||||||
|
|
G |
F |
G |
F |
G |
F |
G |
F |
G |
F |
G |
F |
G |
F |
G |
F |
||||||||
|
100 |
97.5 |
94 |
52.5 |
52 |
117.5 |
115 |
72.5 |
70 |
127.5 |
125 |
82.5 |
80 |
147.5 |
145 |
102.5 |
100 |
||||||||
|
120 |
104 |
100 |
57.5 |
57.5 |
125 |
120 |
75 |
75 |
135 |
130 |
85 |
85 |
155 |
150 |
105 |
105 |
||||||||
|
140 |
108 |
107 |
58 |
60 |
130 |
130 |
77.5 |
75 |
140 |
140 |
87.5 |
85 |
160 |
160 |
107.5 |
105 |
||||||||
|
160 |
117 |
114 |
60 |
62 |
140 |
135 |
80 |
80 |
150 |
145 |
90 |
90 |
170 |
165 |
110 |
110 |
||||||||
|
175 |
125 |
117 |
64 |
64 |
150 |
140 |
85 |
85 |
160 |
150 |
95 |
95 |
180 |
170 |
115 |
115 |
||||||||
Les
conséquences vasculaires de l'HTA
- épaississement et sclérose de la média
- augmentation de la perméabilité
endothéliale
- augmentation de la sensibilité réactive
des cellules de la paroi aux substances vasoconstrictrices
- augmentation de la viscosité (fibrinogène)
du flux sanguin entraînant une augmentation de la contrainte pariétale.
- formation de plaques d'athérome
- fragilisation des plaques d'athérome par
l'augmentation des variations de pression
- dégénérescence artérielle
- raréfaction des artérioles et diminution
de leur calibre
- constitution d'anévrisme du fait des
contraintes imposées aux artères et de la faiblesse pariétale engendrée
par la dégénérescence de la média


Les
conséquences cérébrales de l'HTA
- céphalées (classiquement occipitales,
battantes et matinales)
- infarctus lacunaires (<
- hémorragies cérébrales (classiquement au
niveau des noyaux gris et de la capsule interne)
- infarctus cérébraux non lacunaires par
athérosclérose des vaisseaux cervicaux
- athérosclérose des vaisseaux cérébraux
extra et intra crâniens
- sténoses de la carotide interne et des
artères vertébrales
- lipohyalinose des artères perforantes
intracérébrales
- encéphalopathie hypertensive aiguë
entraînant au début des céphalées occipitales puis générales accrues par
l'effort, des lésions capillaires avec micro-hémorragies
- Les lésions vasculaires peuvent entraîner
un déclin cognitif et le risque de démence dans les quatre ans suivant un
infarctus cérébral est multiplié par 5.5.
- L'HTA pourrait être un facteur de risque
de la maladie d'Alzheimer
Les
conséquences rénales de l'HTA
- Près de 30% des insuffisants rénaux
chroniques aux USA et 15% en Europe sont porteurs d'une néphropathie considérée
comme secondaire à l'hypertension artérielle: la néphroangiosclérose (NAS)
La HTA entraîne des lésions rénales appelées
néphroangiosclérose
- maligne PAD >130 mmHg et insuffisance
rénale progressive
- bénigne par le développement d'une
sclérose hyaline touchant les artérioles afférentes des glomérules. Elle se
rencontre au cours de l'HTA modérée, du diabète et du vieillissement
HTA, protéinurie et diabète multiplient par
7 le risque de décès par rapport à un diabétique normotendu sans protéinurie.
La microalbuminurie est comprise entre 30 et
300 mg/24h. L'apparition d'une microalbuminurie majore le risque
cardio-vasculaire.
Evolution de la néphropathie diabétique:
Stade 1: hypertrophie et hyperfiltration
rénale précoce
Stade II: évolution silencieuse et longue;
épaississements de la membrane basale glomérulaire et prolifération mésangiale
Stade III: néphropathie débutante, touche 30
à 40% des diabètes. Apparition de la microalbuminurie
Stade IV néphropathie clinique avec protéinurie
et HTA
Stade V stade terminal
L'HTA chez l'enfant est toujours secondaire.
Il peut s'agir de la HTA de l'adulte qui se manifeste précocement à
l'adolescence. A côté des symptômes communs de l'HTA, l'HTA de l'enfant peut se
manifester par: vomissements, anorexie, douleurs abdominales, ralentissement de
la croissance, paralysie faciale récidivante…
L'HTA de l'enfant peut provenir:
- d'une surcharge volémique par rétention
hydrosodée
- d'une coarctation de l'aorte
- d'une cause rénale (90% des cas:
néphropathie, cicatrice rénale, polykystoses , sténose de l'artère rénale,
tumeur)
On peut noter chez l'enfant une HVG signe
d'une tension excessive
Le traitement principal est la correction de
l'excès de poids, notamment par la diététique et l'activité physique et l'arrêt
éventuel du tabac. Le traitement pharmacologique sera entrepris en cas d'échec
de la thérapie.
- Le traitement contraceptif oral augmente
la TAS de 5 à 10 mmHg et un peu moins la TAD
- 5% seulement des femmes souffrent de HTA
du fait de la pilule, hors association avec le tabac
- la HTA induite par le contraceptif oral
est sans retentissement et réversible, hors cas de HTA induite par d'autres
facteurs
- le type et la dose du progestatif induisent
des différences de valeur de l'HTA
- le mécanisme principal de la HTA induite
par le contraceptif est l'augmentation de l'angiotensinogène induite par les
œstrogènes de synthèse qui facilite l'activation du système
rénine-angiotensine. D'autre mécanisme sont:
- la résistance
à l'insuline avec hyperinsulinisme associés
souvent aux HTA
-
la rétention sodée induite par les œstrogènes
- il est important de surveiller la tension
et de normaliser impérativement
La ménopause est associée à une majoration
importante de risque cardio-vasculaire du fait des changements hormonaux
qu'elle induit et multiplie le risque de HTA par 2.2. Les risques sont
augmentés en cas de ménopause précoce.
Le mécanisme essentiel de l'HTA après la
ménopause est la disparition des œstrogènes protecteurs avec sclérose
artérielle, prise de poids…
L'HTA est jusqu'à 85 ans le premier risque
d'AVC et d'insuffisance cardiaque de la personne âgée.
- ionogramme sanguin
- dosage de la créatinine plasmatique
- dosage de la glycémie, du cholestérol, des
triglycérides
- recherche d'une protéinurie et d'une
anomalie du sédiment urinaire
- ECG
La régulation de
la pression artérielle met en jeu différents mécanismes interférant entre eux:
Régulation réflexe par l'intermédiaire
des barorécepteurs et des volo-récepteurs (réponse rapide, importante mais de durée brève)
 Les récepteurs sensibles à l'étirement (barorécepteurs) situés au niveau
du sinus carotidien, de l'arc aortique, dans les poumons et les chémorécepteurs
du sinus carotidien et de la crosse aortique transmettent les influx jusqu'au
bulbe et aux centres cardio-vasculaires.
Les récepteurs sensibles à l'étirement (barorécepteurs) situés au niveau
du sinus carotidien, de l'arc aortique, dans les poumons et les chémorécepteurs
du sinus carotidien et de la crosse aortique transmettent les influx jusqu'au
bulbe et aux centres cardio-vasculaires.
En réponse, les
centres déclenchent une diminution de la réponse sympathique et une
augmentation de la décharge parasympathique entraînant ainsi:
- un
ralentissement de FC
- une diminution
de la contractilité myocardique
- une
vasodilatation artériolaire
- une dilatation veineuse
Cette réponse diminue le débit cardiaque et
les résistances périphériques, normalisant ainsi la pression artérielle. Une
augmentation de l'activité du système nerveux autonome se retrouve
systématiquement dans l'HTA.
Régulation hormonale et par neurotransmission
d'origine centrale et périphérique
 Les différents médicaments et drogues ont des actions hypo-tensives par
l'intermédiaire de récepteurs spécifiques.
Les différents médicaments et drogues ont des actions hypo-tensives par
l'intermédiaire de récepteurs spécifiques.
L'administration
centrale de substance P ou d'enképhalines provoque une augmentation de l'activité
sympathique et de la pression artérielle.
En périphérie le
système rénine-angiotensine, l'aldostérone, la vasopressine, la sérotonine sont
hypertenseurs alors que le facteur de relaxation (EDRF), les prostaglandines,
et la dopamine sont hypotensives.
Action du
mécanisme rénal, dépendant du
capital sodé et du volume extra-cellulaire, sur lequel agissent les
diurétiques.
Action du
mécanisme vasoactif permettant la
régulation du débit sanguin régional de certains organismes.
Action de la résistance périphérique
totale modifiée par la viscosité
sanguine, la compliance du lit vasculaire… Plus la résistance périphérique
augmente, plus la tension artérielle augmente. L'augmentation de la résistance
périphérique totale, normale avec l'âge est un des mécanismes aboutissant à
l'insuffisance ventriculaire gauche quand elle est pathologique. L'augmentation
de Ca intracellulaire provoque la contraction du muscle lisse vasculaire
entraînant une augmentation de la RPT.
Action de la
balance sympathique où le système
orthosympathique est hypertenseur et le système parasympathique hypotenseur.
La pression
artérielle varie à chaque battement; de plus, il existe un rythme circadien de
la pression artérielle avec chute vers 2-3 heures du matin et remontée vers 5
heures. L'amplitude des variations circadiennes de la PA est de 10 à 30 mmHg.
Des variations inférieures à 10% de la PA de base ou à 10 mmHg pour la pression
systolique et 5 mmHg pour la pression diastolique sont considérées comme anormales.
Les alternances jour/nuit, les rythmes de travail et de repos, les ajustements
hormonaux, la diététique, la race, l'âge, les émotions, le psychisme, le tonus
nerveux sympathique et beaucoup d'autres facteurs interviennent sur les
variations circadiennes de la pression artérielle.
 L'hypertendu ne présenterait pas de chute nocturne de la pression
artérielle, expliquant ainsi la survenue préférentielle d'accidents
cardio-vasculaires au réveil. Le pic matinal tensionnel étant source
d'accidents dans ce cas. Du fait de ce rythme circadien, le diagnostic d'HTA ne
peut être posé qu'après trois mesures positives à différents moments de la
journée et nécessite une double mesure à un mois d'intervalle à chaque bras. Un
certain nombre d'autres pathologies peuvent modifier le cycle de la PA:
dysautonomies, diabète compliqué, hypercorticismes (ou corticothérapie),
transplantation d'organe, toxémie gravidique, apnées du sommeil…
L'hypertendu ne présenterait pas de chute nocturne de la pression
artérielle, expliquant ainsi la survenue préférentielle d'accidents
cardio-vasculaires au réveil. Le pic matinal tensionnel étant source
d'accidents dans ce cas. Du fait de ce rythme circadien, le diagnostic d'HTA ne
peut être posé qu'après trois mesures positives à différents moments de la
journée et nécessite une double mesure à un mois d'intervalle à chaque bras. Un
certain nombre d'autres pathologies peuvent modifier le cycle de la PA:
dysautonomies, diabète compliqué, hypercorticismes (ou corticothérapie),
transplantation d'organe, toxémie gravidique, apnées du sommeil…
La faible
variation circadienne de la PA est un marqueur indépendant du risque cardio-vasculaire
chez la femme.
la tension systolique moyenne limite est
à 14 cmHg (centimètres de mercure).
la bonne tension diastolique moyenne
(nombre minima) est 9 cmHg.
140/90 délimite l'hypertension pour la
NYHA (HTA limite) ,
160/95 pour l'OMS (HTA confirmée)
Chez les jeunes de 6 à 11 ans, sont
considérées comme HTA une TAS > 13 cmHg et/ou une TAD > 8 cmHg
Chez les jeunes au delà de 12 ans, sont
considérées comme HTA une TAS > 14 cmHg et/ou une TAD > 9 cmHg
L'hypertension
peut se transmettre de manière héréditaire. C'est le cas de la population noire
dont l'hypertension s'élève plus facilement en cas de charge sodée accélérant
la fuite de potassium. L'hypokaliémie accroît l'hypertension. La population
noire est souvent en déficit de magnésium; or le magnesium est antagoniste du
calcium et possède un effet vasodilatateur direct. L'augmentation de calcium
intracellulaire provoque la contraction du muscle lisse vasculaire et une
augmentation des résistances périphériques. La prolifération des cellules des
muscles lisses vasculaires diminue le diamètre artériel et augmente la
résistance, donc
Plus l'HTA est
apparue tôt, plus les chiffres tensionnels sont hauts, plus il y a de facteurs
de risque cardio-vasculaires associés, plus précoces et plus graves seront les
complications.
L'émotion devant le médecin chez des
patients particulièrement émotifs augmente de manière notable
Limites de tension à l'effort:
F chute ou défaut d'augmentation de la tension
artérielle systolique
en-dessous de 5
cmHg pour une Fc Max ³ 150 bat/min
en-dessous de 3
cmHg pour une Fc Max < 115 bat/min
F augmentation anormale de la tension systolique
³ 22 cmHg pour 50% RFc
³ 25 cmHg pour un effort maximal
³ 28 cmHg pour un hypertendu actif en effort maximal
F augmentation de la tension diastolique plus
importante que l'augmentation de la tension systolique
F augmentation de la tension diastolique au delà de 10
ou 12 cmHg
Ce sont essentiellement des céphalées,
vertiges, bourdonnements d'oreille, des mouches volant devant les yeux, bruits
anormaux, troubles visuels transitoires etc...
Les complications engendrées par l'HTA sont
graves:
ü insuffisance cardiaque
ü insuffisance coronarienne
ü accidents vasculaires cérébraux
Plus de 70% des
AVC sont d'origine ischémiques par embolie ou le plus souvent par thrombose de
petits vaisseaux secondaires à l'hypertrophie vasculaire.
Les
complications vasculaires cérébrales sont 5.7 fois moins fréquentes que les
complications cardiaques. L'atteinte cérébrale est plus directement liée à
l'hypertension que l'atteinte cardiaque.
ü accidents sensoriels (surdité, perte de la vue...)
ü insuffisance rénale
L'HTA altère
particulièrement le cœur, le cerveau et les reins à travers l'ensemble de
l'arbre artériel qu'elle soumet en permanence à des contraintes de pression
exagérée.
L'hypertension
peut-être induite par la libération d'hormones hypertensives par certaines
tumeurs. D'autre part l'HTA peut-être facteur de risque du cancer du rein.
La macro-angiopathie
caractérise un vieillissement accéléré des parois artérielles, avec
remplacement du tissu élastique par du tissu conjonctif (par la libération de
facteurs de croissance), altération de l'intima et de la média entraînant la
formation de plaques athéromateuses; elle est responsable des infarctus
viscéraux, cardiaques et cérébraux des patients hypertendus.
La
micro-angiopathie caractérise un épaississement pariétal des artérioles et une
réduction du lit artériolaire conduisant à une augmentation progressive des
résistances vasculaires totales.
Les femmes
hypertendues éprouvent d'avantage de difficultés à ressentir l'orgasme et
souffrent de plus d'une insuffisance de lubrification. Si les hommes souffrent
aussi de troubles de la libido, on sait par contre qu'ils sont dus aux
médicaments hypotenseurs.
Le traitement doit associer médicamentation
hypotensive (bêtabloquants, diurétiques), diminution des facteurs du risque
cardio-vasculaire (tabac, diététique, surcharge pondérale, stress...), exercice
physique aérobie régulier. L'exercice physique doit être d'intensité légère, la
durée étant plus importante. Les efforts statiques importants sont interdits.
Le sport de compétition est déconseillé. On peut espérer une baisse de TAS de
15 mmHg et de TAD de 10 mmHg par la pratique d'activités physiques aérobiques
régulières. En cas d'échec des mesures hygiéno-diététiques, la médicamentation
devra être renforcée notamment par association de différents produits (IEC, IC,
alpha-bloquants). Un traitement hypotenseur fait baisser de 33 à 40% le risque
cérébral et de 14% à 26% le risque coronarien et de 21% le risque
cardio-vasculaire.
En matière de diététique, il faut notamment
éviter les surcharges de sel et réglisse, la nourriture trop riche, les graisses
animales, les fritures, l'alcool. Il faut privilégier le poisson et la cuisine
grillée et à
Nota: un traitement médicamenteux de
l'HTA doit être poursuivi à vie, et ne doit en aucun cas être interrompu sans
autorisation médicale sous peine d'aggravation ou de poussée de l'hypertension.
Mauvais contrôle de l'hypertension:
Deux études européennes récentes rapportent
que 37% seulement des patients ont une tension équilibrée, alors que les médecins
pensent que 76% de leurs patients sont correctement contrôlés. Les patients,
eux, s'estiment correctement contrôlés à 95% des cas. Un contrôle correct
(systole < 140 mmHg et diastole < 90 mmHg) doit assurer sur 24 h après la
prise médicamenteuse un rapport vallée/pic des valeurs de tension systolique
supérieur à 50%.
L'hypertension artérielle gravidique

La HTAG est une affection qui touche 10 à 15
des grossesses et est responsable de 30% des décès maternels et de 20% des
décès fœtaux dont elle est la première cause de morbidité essentiellement par
ischémie placentaire.
La HTAG est 6 fois plus fréquente lors d'une
première grossesse, la HTA chronique touche 3% de l'ensemble des grossesses, et
les grossesses gémellaires multiplient par 5 le risque de pré-éclampsie.
 Complications
Complications
G l'éclampsie complique une grossesse sur 1000. Elle
est induite par la HTA et se caractérise par une crise convulsive brutale.
G l'hématome rétro-placentaire est la conséquence d'un
décollement prématuré du placenta, d'origine ischémique.
G l'hypotrophie fœtale complique 7 à 20% des
grossesses et apparaît le plus souvent au cours du 3ème trimestre de
G la prématurité
G protéinurie dans 10% des cas multipliant le risque
fœtal par 20
G œdèmes diffus des membres inférieurs, des mains
et/ou de la face
La HTAG est le principal symptôme de la
déficience de la connexion sanguine mère- fœtus; elle se manifeste vers 18
semaines d'aménorrhée. Elle entraîne des troubles de la coagulation qui
aggravent l'asphyxie du placenta et peuvent engendrer des troubles rénaux,
hépatiques et cérébraux.
Le risque de récidive de la pré-éclampsie au
cours d'une grossesse ultérieure est de 70%. L'éclampsie est un marqueur
autonome du risque cardio-vasculaire de
Le traitement de la HTAG ne repose plus sur
l'abaissement des chiffres tensionnels puisqu'il s'agit d'un symptôme. On
essaiera de réguler le flux sanguin utéro-placentaire par des mesures
hygiéno-diététiques (repos en position couchée sur le côté, arrêt du travail,
relaxation...). Le régime sans sel, les diurétiques et les IEC sont
contre-indiqués. Le seul traitement préventif de l'éclampsie est l'aspirine à
dose anti-agrégantes (50 à 100 mg/j) pour les patientes à haut risque.
L'accouchement est en fait le seul traitement curatif. La pression artérielle
doit être abaissée lentement et progressivement sans descendre en-dessous de
140/90. Les IEC sont contre-indiqués et les diurétiques sont néfastes à la
circulation placentaire.
Les cardiopathies congénitales
 l Rétrécissements valvulaires
(sténoses), coarctation de l'aorte (rétrécissement de la zone isthmique de la
crosse aortique)
l Rétrécissements valvulaires
(sténoses), coarctation de l'aorte (rétrécissement de la zone isthmique de la
crosse aortique)
l
Cardiopathies
l avec shunt gauche-droite renvoyant du sang rouge
dans le cœur droit et engendrant une insuffisance cardiaque, communications
interauriculaires, communications interventriculaires, persistance du canal
artériel (communication entre l'aorte et l'artère pulmonaire), canal
atrio-ventriculaire
l cardiopathies complexes avec shunt droite-gauche
cyanosant, tétralogie de Fallot comportant une communication
entre les deux ventricules et un rétrécissement gênant l'éjection du sang bleu
vers l'artère pulmonaire, transpositions des gros vaisseaux...
 l cardiomyopathie
hypertrophique sans cause apparente (HTA, infarctus). Elle peut avoir une forme
dilatée (augmentation de la taille des cavités et diminution de la fonction
contractile du cœur) ou hypertrophique avec épaississement anormal du myocarde.
Elle est dite obstructive quand l'épaississement du septum est tel qu'il crée
un obstacle à l'éjection du sang.
l cardiomyopathie
hypertrophique sans cause apparente (HTA, infarctus). Elle peut avoir une forme
dilatée (augmentation de la taille des cavités et diminution de la fonction
contractile du cœur) ou hypertrophique avec épaississement anormal du myocarde.
Elle est dite obstructive quand l'épaississement du septum est tel qu'il crée
un obstacle à l'éjection du sang.
Les symptômes peuvent exister ou non (dyspnée,
palpitations, insuffisance cardiaque, syncopes). Les bruits auscultatoires sont
anormaux. Les deux grands symptômes possibles sont ceux de l'insuffisance
cardiaque et
ü une coloration gris-bleutée, parfois violacée de la
peau de l'extrémité du nez, des oreilles, des lèvres, de la langue ...
ü la cyanose s'accentue à l'effort et aux cris
ü l'extrémité des doigts est renflée et les ongles
bombés (hippocratisme digital)
ü les gencives sont hypertrophiées, gonflées, de
couleur plus sombre
les yeux sont
rouges, comme si l'enfant avait pleuré
L'origine des cardiopathies congénitales
peut provenir:
ü de l'hérédité, d'une anomalie des chromosomes
(enfant à malformations multiples),
ü d'une infection (rubéole),
ü d'une intoxication médicamenteuse pendant la période
vulnérable de la grossesse (entre la 3ème et la 8ème
semaine),
ü d'une intoxication notamment alcool et tabac.
L'espérance de vie est très variable, mais
dépasse rarement 50 ans en l'absence de traitement.
Le traitement médical permet de traiter
l'insuffisance cardiaque, seul le traitement chirurgical permettant (avec
succès le plus souvent) de corriger la malformation.
Les vaccinations et la prévention des foyers
infectieux, notamment buccaux sont très importants pour la santé de l'enfant
cardiaque extrêmement fragilisé par son handicap. Le réentraînement à l'effort
n'a d'intérêt que pour lutter contre le syndrome de désadaptation, mais
l'activité physique modérée reste physiquement et psychologiquement
souhaitable.
Les séjours à plus de
Les troubles du rythme cardiaque
Les extrasystoles
sont des impulsions prématurées qui peuvent être générées par chaque groupe de
cellules du tissu nodal.
Ses causes sur
un cœur sain sont essentiellement une hypokaliémie ou une hypomagnésémie.
Les
extrasystoles supraventriculaires sont très fréquentes dans toutes les
cardiopathies et surtout dans les cardiopathies mitrales, myocardiopathies,
HTA.
è Les symptômes sont des secousses, des coups dans la
poitrine, souvent avec une irradiation cervicale.
è Lors de l'ES la mesure du pouls manque et est suivie
d'une impulsion plus forte.
è A l'auscultation, l'ES fait entendre un bruit
prématuré suivi d'un silence plus long et d'un bruit plus fort.
è A l'ECG qRs est < 12/100ème de seconde
(fin) quand l'ES est supraventriculaire, et est ³ 12/100ème s (large)
quand elle est ventriculaire.
Les ESV peuvent
être
n en doublets ou en triplets (2 ou 3 ESV de suite en
salve)
n bigéminées (à chaque qRs normal fait suite une ESV)
n trigéminées (à chaque qRs normal fait suite une ESV)
n polymorphes lorsqu'elles associent plusieurs formes
n monomorphes quand elles ont une seule forme
n précoces lorsqu'elles tombent dans l'onde T
précédente
Sur le cœur
sain, les ES n'ont habituellement pas de conséquence. Elles se traitent par des
sels de magnésium et des antiarythmiques légers.
Sur le cœur
malade, elles évoluent vers des troubles du rythme plus sévères. Les ES
ventriculaires sont très graves chez les coronariens et peuvent entraîner une
fibrillation ventriculaire mortelle. Les ESV imposent l'arrêt du RE. Elles se
traitent essentiellement par des antiarythmiques.
Après infarctus
30% des patients ont des ESV isolées et monomorphes, 7 à 11% ont des formes
répétitives.
La bradycardie
est un ralentissement aléatoire ou permanent, voire un arrêt transitoire du
rythme cardiaque. Son étiologie peut provenir d'un(e)
n dysfonctionnement sinusal,
n bloc sino-auriculaire
n bloc auriculo-ventriculaire
n hypersensibilité carotidienne
n hypertonie vagale
Les bradycardies
chroniques sont essentiellement dues à la dégénérescence sénile du tissu nodal,
alors que les bradycardies aiguës proviennent essentiellement de l'infarctus du
myocarde et de certaines maladies infectieuses.
La bradycardie
permanente présente un tableau d'insuffisance globale. L'arrêt transitoire de
l'activité cardiaque par défaut de rythme de relais entraîne la syncope et
parfois la mort subite (syndrome de Stockes-Adams). Les bradycardies chroniques
répètent leurs syncopes jusqu'à survenue du décès. Les bradycardies aiguës régressent
avec le traitement de la pathologie originale.
Le traitement de
la syncope demande massage cardiaque, et bouche à bouche en cas de
prolongation. L'isuprel sublingual ou en perfusion et l'entraînement
électro-systolique sont indiqués en cas de syncope.
Le traitement de
la bradycardie se fait par implantation d'un stimulateur cardiaque.
Sur l'ECG, on
peut observer
l dysfonctionnement sinusal: Fc < 50 bats/min
l bloc sino-auriculaire: deux ondes P sont séparées
par un espace double d'un espace P-P normal sans aucun qRs dans cet intervalle
l bloc auriculo-ventriculaire:
- 1er
degré: espace PR ³ 22/100ème s
- 2ème
degré: après certaines ondes P, il manque un qRs
- bloc AV
complet: le rythme des ondes P est normal, celui des qRs est régulier mais plus
lent. Si le rythme de relais est d'origine ventriculaire, les qRs sont >
0.12 s à un rythme entre 20 et 45 bats/min.
Les tachycardies
sont des troubles du rythme cardiaque entraînant une contraction anormalement
rapide des ventricules de manière aléatoire (paroxystique) ou permanente. Elles
sont d'origine:
l supraventriculaires
l auriculaires
l jonctionnelles (jonction auriculo-ventriculaire)
l ventriculaires
Leur étiologie
principale en est les valvulopathies mitrales, HTA, le vieillissement dans les
tachycardies supraventriculaires et l'insuffisance coronarienne, voire les
cardiomyopathies dans les tachycardies ventriculaires. La tachycardie peut
aussi survenir en l'absence de toute cardiopathie.
Les troubles
fonctionnels de la tachycardie sont: palpitations, voire dyspnées, malaises,
douleurs thoraciques.
l A l'ECG les qRs des tachycardies supraventriculaires
sont < 12/100ème s.
l Les qRs des tachycardies ventriculaires sont ³ 12/100ème
s. l'hospitalisation est nécessaire immédiatement. Les ondes P et la séquence
régulière P-PR-qRs n'apparaissent plus.
l Tachyarythmie par fibrillation auriculaire: les
ondes P sont remplacées par des ondes de fibrillation. Les qRs sont irréguliers
entre 140 et 180 de fréquence.
l Flutter auriculaire: les ondes P sont remplacées par
des ondes F à 300 bats/min. Les qRs sont réguliers à 150 de fréquence.
l Tachysystolie ou tachycardie atriale: les ondes P
sont de fréquence ³ 200. Les qRs sont réguliers à une fréquence deux
fois moindre que celle des ondes P'.
l Tachycardie jonctionnelle ou tachycardie de
Bouveret. Les ondes P sont négatives. Les qRs sont fins et très rapides. Cette
tachycardie fréquente, y compris chez des sujets jeunes débute et s'arrête
brutalement. Elle peut souvent être interrompue par des manœuvres qui stimulent
le système nerveux parasympathique, comme l'expiration forcée, nez et bouche
fermée, le chatouillement de la luette ou du pharynx, la déglutition d'une grosse
bouchée de pain ou d'un verre d'eau glacée, l'accroupissement en étendant les
bras.
l Le syndrome de Wolf Parkinson White (WPW) est
l'existence d'une deuxième voie conduisant le courant des oreillettes aux
ventricules. Normalement, sans aucune conséquence, elle peut provoquer ou
aggraver une tachycardie.
Les tachycardies
ventriculaires et supraventriculaires surviennent plus volontiers entre 90 et
100% de FC Max.
Les tachycardies
ventriculaires et jonctionnelles sont d'un pronostic réservé et doivent être impérativement
réduites. L'évolution des autres tachycardies supraventriculaires dépend des
pathologies d'origine. Elles peuvent néanmoins provoquer OAP, chute
tensionnelle, embolie systémique, problème coronarien, ou mort subite pendant
la cardiopathie.
Le traitement
des cardiopathies fait appel au choc électrique externe sous anesthésie
générale si le patient est conscient (cas d'urgence), aux antiarythmiques
injectables (cordarone et xylocaïne).
La fibrillation
ventriculaire (FV)
La fibrillation
ventriculaire est une tétanisation ventriculaire engendrant une impossibilité
d'éjection systolique. La fibrillation empêche les ventricules de se contracter
de façon unifiée; le sang n‘est plus pompé de façon efficace et le débit
cardiaque diminue considérablement.
La FV peut être
provoquée par toute cardiopathie suffisamment avancée et principalement par les
épisodes coronariens et notamment l'infarctus.
Ses facteurs
déclenchants principaux sont:
à ischémie myocardique aiguë
à ESV et tachycardies ventriculaires du coronarien
à surdoses médicamenteuses
à hypokaliémie
On note une
syncope brutale, parfois avec convulsions. Le patient est en état de mort
apparente. Le décès survient si aucun traitement n'est appliqué dans les trois
minutes suivant l'épisode:
F défibrillation électrique
F dans l'attente entreprendre une réanimation
cardio-pulmonaire (massage cardiaque + bouche à bouche)
F après réanimation du patient, mise en place d'un
traitement antiarythmique ventriculaire et parfois d'un défibrillateur
implanté.
Les contractions
ventriculaires prématurées à l’effort dénoncent généralement la présence d’une
athérosclérose ischémique grave qui touche souvent deux ou trois vaisseaux
coronaires majeurs.
L‘incidence de
mort subite par fibrillation ventriculaire est généralement 6 à 10 fois plus
élevée chez ceux qui montrent des contractions ventriculaires prématurées que
chez les cardiaques ne présentant pas cette anomalie.
C'est le plus
répandu des troubles du rythme, sa fréquence augmentant avec l'âge.15 à 20% des
fibrillations auriculaires n'ont pas de cause apparente. Elles peuvent découler
d'une pathologie cardiaque (80%) comme de l'abus d'excitants. La fibrillation
auriculaire vagale survient essentiellement la nuit ou au repos, alors que la
fibrillation auriculaire adrénergique survient au cours de la journée, pendant
l'effort ou suite à un choc émotionnel. 15% des accidents ischémiques cérébraux
sont d'origine cardiaque, induits par une fibrillation auriculaire. Le risque
d'embolie cérébrale est multiplié par 5.6 en cas de fibrillation auriculaire
non lié à une cardiopathie valvulaire et par 17.5 lorsque le trouble du rythme
est une séquelle d'une maladie rhumatismale.
La dysplasie arythmogène
du ventricule droit
La dysplasie
arythmogène ventriculaire droite est d'une étiologie difficile. Elle touche
essentiellement le sujet jeune avec tachycardie ventriculaire montrant un
aspect de retard gauche. On détecte à l'autopsie une infiltration graisseuse
parfois associée à une fibrose de la paroi ventriculaire. Elle est très
difficile à détecter préventivement et aucune méthode actuellement n'est
réellement plus efficace qu'une autre.
La présence de
potentiels tardifs ventriculaires chez un sportif très entraîné est
probablement un élément diagnostic important en faveur d'une pathologie
cardiaque et particulièrement d'une dysplasie arythmogène ventriculaire droite.
Les maladies d'origine coronariennes
 C'est un défaut complet ou incomplet d'apport sanguin coronarien à une
zone myocardique, soit par :
C'est un défaut complet ou incomplet d'apport sanguin coronarien à une
zone myocardique, soit par :
sténose d'une artère coronaire:
 Il s'agit de la constitution d'une plaque d'athérome constituée de
lipides, glucides complexes, plaquettes sanguines, calcaire et tissu fibreux.
L'athérome généralement précoce, réduit les capacités d'adaptation du débit
sanguin coronarien à l'effort et ne devient significatif qu'à partir d'un
rétrécissement de 70% de la lumière artérielle (50% pour le tronc de la
coronaire gauche), en fait le plus souvent après 40 ans. Le développement des athéromes
est conditionné par les facteurs de risque (âge, sexe, tabac, sédentarité,
alimentation, hérédité etc...)
Il s'agit de la constitution d'une plaque d'athérome constituée de
lipides, glucides complexes, plaquettes sanguines, calcaire et tissu fibreux.
L'athérome généralement précoce, réduit les capacités d'adaptation du débit
sanguin coronarien à l'effort et ne devient significatif qu'à partir d'un
rétrécissement de 70% de la lumière artérielle (50% pour le tronc de la
coronaire gauche), en fait le plus souvent après 40 ans. Le développement des athéromes
est conditionné par les facteurs de risque (âge, sexe, tabac, sédentarité,
alimentation, hérédité etc...)
Il s'agit d'une
vasoconstriction des muscles lisses d'une artère coronaire par excitation
anormale du tonus vasomoteur constricteur. Ce spasme est généralement localisé
précisément et transitoire. Son effet est le même que la sténose à laquelle il
est parfois joint. On évoque le diagnostic de spasme coronarien quand la
douleur survient à heure fixe, en dehors de tout effort, généralement au début
de la deuxième partie de la nuit, au moment des modifications nycthémérales des
tonus ortho et parasympathique. Le spasme est fréquemment provoqué par le froid
ou la fumée de tabac. On peut évoquer le spasme lors des douleurs angineuses
survenant en hyperpnée (tonus vagal important). Le spasme coronaire peut
survenir sur des coronaires normales notamment chez la femme jeune.
provoqué
essentiellement par une sténose athéromateuse. La rupture de la plaque (lésion
endothéliale) déclenche la formation d'un caillot qui peut gêner l'écoulement
du sang (sténose), migrer (embolie) ou occlure l'artère (infarctus).
L'ischémie est
dite:
F réversible quand les cellules myocardiques privées
d'oxygène ne sont pas endommagées (en général moins de 6 heures). L'ischémie
réversible se caractérise par des troubles disparaissant avec elle. Le patient
peut présenter:
l une douleur thoracique (angor)
l et/ou des troubles de la conduction:
l sur segment ST et onde T
l ESV, tachycardie voire fibrillations ventriculaires
l et/ou insuffisance VG (avec parfois OAP)
F irréversible quand les cellules myocardiques
subissent des dommages irréversibles, même si elles sont reperfusées ensuite.
L'ischémie irréversible engendre une zone de nécrose, il s'agit de l'infarctus
du myocarde.
F L'ischémie silencieuse, sans douleur, est plus
fréquente en cas d'atteinte de plusieurs vaisseaux. On note régulièrement aux
environs de 65% à 75% de maladies coronaires silencieuses. La surveillance du
décalage du segment ST à l'ECG permet de détecter les ischémies silencieuses.
L'ischémie est
plus grave que l'hypoxie. Une sténose de 50% induit des perturbations
métaboliques et diminue la fonction myocardique, même si 70 à 80% est le degré
de sténose habituellement retenu comme entraînant une ischémie. Pour entraîner
une sténose critique, la plaque d'athérome doit diminuer le diamètre du tronc
de 70 à 80% au repos et de 50% à l'effort.
Chez un patient
atteint de maladie coronaire, le temps d'éjection est plus long. L'altération
de la compliance provient d'une mauvaise relaxation du myocarde, due entre
autre, au mauvais retour des ions Calcium induit par l'hypoxie.
L'évolution
normale du thrombus est sa lyse en quelques jours. Les thrombolytiques utilisés
au stade aigu de l'infarctus ont pour but de reperfuser les cellules
myocardiques avant que l'ischémie ne soit irréversible.
Les dépôts
athéromateux en réduisant l'approvisionnement sanguin d'une artère coronaire
vont induire le développement d'une circulation collatérale entre les artères
pour suppléer à cette anomalie. Cette circulation collatérale, évitera souvent
à l'ischémie de devenir irréversible lors d'un thrombus. On retrouve ce tableau
dans le cas de personnes plus âgées chez qui ce réseau a eu le temps de se
développer. Par contre dans les infarctus aigus et notamment ceux des personnes
jeunes, cette circulation collatérale n'a pas été développée et ne peut
suppléer l'artère défaillante. Il n'a pas été formellement mis en évidence que
l'exercice physique permettait de développer cette circulation collatérale.
l Il semble qu'il faille une sténose de 75% minimum,
pour développer un réseau collatéral.
l Dans le meilleur des cas, le réseau collatéral ne
peut assurer plus de 40% du débit coronaire normal.
Pour faire face
à l'ischémie le myocarde s'organise pour stopper la contraction des zones
insuffisamment perfusées avant une éventuelle lésion, et supplée à ce travail
par la contraction des zones saines, redistribue du sang des zones saines vers
les zones ischémiques, et ralentit la FC pour allonger la diastole et donc
améliorer le débit coronaire. La réserve de vasodilatation est le mécanisme qui
permet par hyperhémie réactionnelle d'augmenter le débit coronaire jusqu'à 8
fois sa valeur de base en réponse à une occlusion, comme une compression
artérielle. Cette capacité de réserve est progressivement abolie par la
progression de
Le myocarde
ischémique n'utilise pas d'AGL. L'apport énergétique se fait normalement à 65%
d'acides gras et 35% de glycogène et glucose. En cas d'ischémie, l'apport n'est
plus assuré que par les hydrates de carbone et il y a formation de lactates
dans le sinus coronaire, avec libération de potassium intracellulaire induisant
des troubles du rythme.
l Une concentration importante en AGL ou une carence
en carnitine induisent des arythmies chez le patient souffrant d'un infarctus.
L'angine de poitrine ou
crise d'angor
La douleur
angineuse est la manifestation de l'ischémie réversible. Elle se caractérise
par une douleur thoracique rétrosternale, large (décrite avec les deux mains)
avec sensation de constriction (serrement, étau, pinces) et de brûlure pouvant
irradier au bras gauche et jusqu'au maxillaire inférieur.
Cette douleur
survient à l'effort, au froid, ou face au vent. Elle cède rapidement à l'arrêt
de l'effort ou suite à l'ingestion de trinitrine sublinguale (en moins de 2
mn). Il existe plusieurs types d'angor:
ð blockpnée d'effort: (dyspnée > douleur)
ð angors incertains: (symptômes incertains)
ð angor par spasme coronaire pur dont le très grave
angor de Prinzmetal qui est un syndrome d'angor vasospastique
ð angor de Novo: angor débutant
ð angor instable: malgré le traitement, les crises
deviennent de plus en plus fréquentes et de plus en plus facilement; elles sont
plus longues et plus résistantes à la trinitrine
ð le syndrome de menace d'infarctus du myocarde: angor
de repos dépassant 20 mn, résistant à la trinitrine, avec un tracé ECG évoquant
l'infarctus, mais se résorbant sans traitement.
Les douleurs
d'angine de poitrine se manifestent généralement au cours d’un exercice qui
exige un plus grand apport de sang au myocarde. Au repos, l’irrigation
cardiaque ne fait défaut que si l’obstruction de la circulation coronaire
atteint 80%. En réalité, l’obstruction peut atteindre au moins 50 à 70% avant
qu’on puisse détecter la maladie cliniquement. En général, la mortalité par
maladie coronaire se produit après obstruction marquée de plusieurs artères
importantes du myocarde.
L'influx de la
douleur angineuse suit le trajet nerveux de C8 et des 4 premières dorsales.
L'ischémie entraîne la libération de substances algogènes qui vont stimuler de
nombreuses terminaisons sympathiques. La douleur angineuse entraîne une
diminution de la température cutanée dans la région douloureuse.
L'ECG hors crise
est normal chez deux tiers des patients. Dans le tiers de patients où le tracé
ECG apparaît anormal, on enregistre une inversion triangulaire symétrique de
l'onde T (signe d'ischémie sous-epicardique).
L'ECG en crise
montrera un tracé anormal avec sous-décalage ST (lésion sous-endocardique). Le
sus-décalage ST est plus rare et plus grave.
L'épreuve
d'effort pour être positive recherchera les conditions de l'angor pour mettre
en évidence un sous-décalage horizontal ou descendant ³
L'épreuve
d'effort reste néanmoins incertaine pour un tiers des patients, car elle peut
être faussement négative ou faussement positive.
La scintigraphie
au thallium couplée à l'épreuve d'effort atteint un taux de certitude de 85%.
La coronographie est le moyen le plus sûr de diagnostic, mais est invasive et
coûteuse.
L'évolution de l'angor est diverse suivant
les patients et les lésions. On
peut néanmoins
craindre:
ð l'infarctus dans les dix ans qui suivent la crise
ð une insuffisance cardiaque
ð des troubles du rythme cardiaque
ð une mort subite
Le traitement de
l'angor comprend:
þ arrêt de l'effort
þ dérivés nitrés en prise sublinguale d'action rapide
(trinitrine, natirose, natispray etc..) à renouveler en cas d'échec. Ces
médicaments peuvent induire hypotension et céphalées transitoire. L'aspirine
est excellente pour freiner l'évolution du processus d'angor. On lui associe
fréquemment l'héparine ou l'hirudine pour leur activité anticoagulante.
þ hospitalisation d'urgence en cas de résistance aux
nitrés
þ La survie des malades traités médicalement après un
épisode d'angor instable ou d'infarctus est de 80% à 5 ans, 61% à 10 ans, et de
43% à 15 ans.
þ Le traitement de l'angor instable doit être traité
en service de cardiologie; il est dirigé contre l'agrégation plaquettaire à
base d'aspirine. L'angioplastie doit être différée de quelques jours quand elle
est possible et se pratiquer sur un patient stabilisé; la stabilisation
intervient par association d'un traitement antithrombotique et anti-ischémique.
50% des cas
d'infarctus aigus ont été précédé d'une phase d'angor instable méconnue ou
insuffisamment traitée. La stabilisation à l'hôpital permet d'éviter la nécrose
dans 95% des cas. Les infarctus suivant un angor instable sont moins graves
notamment du fait qu'une circulation collatérale a le temps de se développer.
En conséquence l'hospitalisation immédiate en milieu spécialisé de tout patient
suspect d'instabilité angineuse est indispensable.
L'angor instable
est difficile à cerner puisque recouvrant plus de 50 formes différentes d'après
JP Broustet. On classera comme angor instable toutes les douleurs angineuses de
repos, les angors d'effort brutalement aggravés, l'angor d'effort de Novo
(douleur modérée). L'angor instable correspond à une aggravation de la demande
en oxygène et dans la majorité des cas à une diminution brutale du débit de
perfusion (aggravation de la sténose). L'angor primaire comme l'infarctus
associe rupture d'une plaque d'athérome et thrombose.
La prévention de
l'angor comprend:
þ prévention de l'athérogenèse (hygiène de vie)
þ réentraînement à l'effort
þ médicaments de prévention de l'angor et de
l'athérome
þ angioplastie transluminale (introduction d'un
ballonnet gonflable dans les coronaires afin d'écraser les dépôts athéromateux.
þ pontage aorto-coronarien si la sténose est proximale
et
si le réseau aval est de bonne qualité.
Diagnostic différentiel de l'angine de poitrine
La dysfonction
œsophagienne détermine des douleurs semblables à celles de l'angine de
poitrine. Elles proviennent d'un reflux gastro-œsophagien, souvent aggravé par
le tabac.
Le syndrome X
couvre les autres mécanismes de la douleur différentielle de l'angine de
poitrine, notamment tous les syndromes psychologiques, puisque 40% de ces
sujets souffrent de névrose.
L'infarctus est le fait d'une obstruction
coronaire, souvent du fait d'une sténose athéromateuse induisant une ischémie
irréversible de la zone non irriguée et une nécrose des tissus. L'infarctus
touche essentiellement le ventricule gauche, néanmoins il peut s'étendre au
ventricule droit et aux oreillettes. Il se déclare habituellement la nuit, au
repos et touche plus les hommes que les femmes (2/3) notamment aux alentours de
60 ans. Les facteurs de risque aggravent très fortement ces statistiques.
L'infarctus du myocarde est à 50% la première manifestation de la pathologie
coronaire; il survient à 25% au cours d'un exercice.

Une crise cardiaque survient
lorsqu’une artère coronaire est bloquée. Lorsque l’obstruction se situe à
l'extrémité distale de l’artère, les dommages sont moins importants que si elle
survient à l’extrémité proximale de l'artère étant donné que la région de tissu
privée d'oxygène est moins grande.
L'infarctus du myocarde se caractérise par :
ð une douleur angineuse très forte pouvant irradier
les deux bras, le dos, l'épigastre résistant à la trinitrine,
et souvent par :
ð une chute tensionnelle
ð une bradycardie
ð des anomalies à l'auscultation
ð une fièvre le lendemain qui dure quelques jours
ð un tracé ECG ou ST qui s'élève et englobe T (onde de
Pardee)
Si on peut
suspecter l'IDM du fait de la description de la douleur, quoique parfois
absente (essentiellement chez le diabétique ou le patient âgé) et de l'étude
des facteurs de risque, seul l'ECG permet d'affirmer le diagnostic.
ð une impossibilité à extraire les substrats
lipidiques. L'alimentation du myocarde ischémique n'est plus assuré que par les
hydrates de carbone, et l'augmentation de lactates dans le sinus coronaire est
la preuve de l'ischémie myocardique. Après IDM le bilan lipidique ne sert qu'au
diagnostic car il est faussé.
ð une modification du taux de certains enzymes
sanguins; les CPK dépassent le double des valeurs normales à partir de la 3ème
heure.
 La douleur disparaît en quelques heures, et dès le 3ème jour
post-infarctus, l'organisme entreprend de nettoyer la zone nécrosée. Cette zone
est fragile et pendant une semaine on peut craindre des complications:
La douleur disparaît en quelques heures, et dès le 3ème jour
post-infarctus, l'organisme entreprend de nettoyer la zone nécrosée. Cette zone
est fragile et pendant une semaine on peut craindre des complications:
F choc
cardiogénique primaire (3 à 4%) ou secondaire (5%)
F rupture
septale (1%)
F insuffisance
mitrale aiguë résultant d'une rupture ou de la dysfonction
d'un
élément valvulaire (1%)
F rupture
de la paroi libre, complication de la deuxième semaine des
infarctus
antérieurs (2%)
 F
infarctus étendu au ventricule droit, notamment en cas d'infarctus
F
infarctus étendu au ventricule droit, notamment en cas d'infarctus
inférieur
(20%)
F un risque de rupture ou d'anévrisme du VG (12%) dans
les formes graves. Les anévrismes sont des dilatations qui se forment aux
endroits affaiblis de la paroi des artères; ils sont souvent liés à
l’hypertension, leur rupture au niveau du cerveau provoque un accident
vasculaire cérébral.
F ESV (chez 70% des patients) avec parfois
tachycardies ventriculaires ou fibrillations ventriculaires
F sidération de la zone nécrosée
F insuffisance cardiaque gauche précoce (5%) du fait
de la sidération de la zone infarcie
F thrombose ventriculaire gauche
F thromboses veineuses du fait de l'alitement des
patients
F péricardite aiguë
Au bout de la deuxième semaine, la
cicatrisation commence, le tissu conjonctif progressant d'environ
Le cœur développe ensuite une hypertrophie
compensatrice du myocarde sain pour rétablir le volume d'éjection systolique et
le débit cardiaque. Le cœur parallèlement développe une circulation collatérale
pour contourner
Des complications tardives peuvent survenir:
à troubles du rythme:
à ventriculaires (ESV ou tachycardie ou fibrillation
ventriculaires entraînant la mort)
à supraventriculaires
à choc cardiogénique secondaire
à complication thrombo-embolique due à l'alitement et
au faible débit cardiaque
à insuffisance cardiaque qui limitera sévèrement le RE
à péricardite (syndrome de Dressler) survenant entre
la 3ème semaine et le 3ème mois. Le RE doit être
interrompu.
à anévrisme post-infarctus (10% des patients): il
s'agit d'une dilatation de la zone infarcie pouvant entraîner des anomalies
ventriculaires du rythme, des thromboses, une insuffisance cardiaque.
L'ablation chirurgicale de l'anévrisme est nécessaire si elle est possible.
à réapparition de l'angor
à récidive d'infarctus
Nota: Le timbre "patch
nicotine" n'est pas dangereux 15 jours après IDM.
Prise en charge de l'IDM en urgence
Le traitement de l'infarctus aigu comprend
en hospitalisation d'urgence:
ü oxygène nasal
ü antalgiques, anxiolytiques
ü association aspirine + streptokinase (6 à 9% de
mortalité à 30 jours)
- 160 mg aspirine per os ou 500 mg en
intraveineux en cas de vomissements
ü anticoagulants
ü antiarythmiques ventriculaires
ü dérivés nitrés et antiangineux
ü thrombolytiques avant la 6ème heure (la
nécrose est constituée après 4 à 6 h d'ischémie)
ü héparine
ü en cas de malaise vagal, surélever les jambes du
patient, en cas d'inefficacité injecter 0.5 mg d'atropine en l'absence de
contre-indication.
ü en cas d'arrêt cardiaque par tachycardie ou
fibrillation ventriculaires utiliser les manœuvres classiques de réanimation
(coup de poing sternal, massage cardiaque externe et ventilation par masque ou
bouche à bouche ).
ü l'angioplastie coronaire, notamment en cas de
contre-indication aux thrombolytiques, avant la 4ème heure améliore
beaucoup le pronostic vital.
La dépression chez les cardiaques
Le syndrome dépressif se retrouve
régulièrement dans les pathologies cardiaques (20 à 30%). Il est souvent
présent lors de l'accident; en post-accident, il se manifeste par une anxiété
les 2 ou 3 premiers jours. Ensuite la peur et l'énergie vitale déployée pour
"s'en sortir" s'estompent et la dépression peut s'installer, avec un
sommeil perturbé, que les soins nocturnes amplifient. Le retour à la maison, le
manque d'activité et l'ennui aggravent la dépression, car le patient prend
mieux conscience de son handicap. La perte d'image et la mauvaise ou non
information sont des facteurs sensibles de la dépression.
La dépression post-infarctus est en général
de 3 à 4 mois, temps nécessaire pour faire le deuil de la vie antérieure.
La dépression est cause de non-reprise du
travail dans 50% des cas. Il faut néanmoins faire la part du handicap revenant
au système de protection sociale qui permet facilement au patient de ne pas
reprendre le travail. 10 à 15% seulement des patients restent réellement
dépressifs au point de ne pas pouvoir reprendre leurs activités. La dépression
est en elle-même un facteur de récidive d'infarctus ou de complications, la
mortalité étant supérieure de 3 à 6 fois chez les patients déprimés.
4 des 10 facteurs suivants doivent être
présents pour poser le diagnostic de dépression:
- modification
de l'appétit
- modification
du sommeil
- désintérêt des
loisirs et sports
- baisse de
libido
- manque
d'espoir dans l'avenir
- irritabilité
- difficulté de
concentration et de mémoire
- idées de
suicide
- symptômes de
somatisation
- sentiment
d'anxiété et de dépression*
- sentiment de
grief
La fatigue notée après un infarctus sans
insuffisance cardiaque est probablement due à la dépression ou à la
sur-médicamentation; cependant les bêtabloquants sont importants dans le stress
car ils protègent le cœur des effets des décharges de catécholamines.
En cas de dépression, sont généralement
prescrits des antidépresseurs classiques et en cas de troubles du sommeil, on
utilise plutôt un somnifère véritable qu'une benzodiazépine.
Une bonne information dès le début de la
maladie est la plus sûre prévention de la dépression chez le cardiaque.
Le rythme
des accidents cardiaques
Il existe un rythme circadien des accidents
cardiaques avec un pic dans les quatre heures suivant le réveil au moment où le
taux de noradrénaline et la tension sont les plus élevés.
Il existe aussi un rythme hebdomadaire lié
au stress avec un pic des accidents le lundi (21%) et un plus petit le
vendredi. Le nombre d'accidents décline en milieu de semaine et est au plus bas
le samedi et dimanche (9.4%). Cette distribution se retrouve même chez les
retraités. Les causes en sont une libération des cathécolamines et autres
hormones du stress ces jours là, le rythme de cette production d'hormones étant
devenu habituel sous l'effet de
è à cœur fermé (CF)
è à cœur ouvert (CO)
è pendant laquelle la circulation sanguine est dérivée
dans un appareillage de circulation extracorporelle (CEC) qui assure la
fonction cœur-poumon durant l'intervention;
è sous hypothermie profonde en arrêt circulatoire
total où la CEC refroidit la température du patient à
La sternotomie médiane est la voie la plus utilisée, car elle offre le
meilleur accès aux quatre chambres cardiaques, aux artères coronaires et aux
gros vaisseaux.
l incision du dessus de la fourchette sternale à
l'appendice xyphoïde ±
l division du ligament interclaviculaire
l division longitudinale du sternum
l écartement des bords du sternum ±
l incision du péricarde jusqu'au diaphragme
l après l'intervention fermeture par 5 à 6 boucles
d'acier
l consolidation osseuse dans les 6 semaines
Risques:
ü fractures du sternum, de côtes, ou de cartilages
costaux à l'écartement en cas de déminéralisation osseuse (personnes âgées)
ü lésion des articulations costo-vertébrales
(rhumatisants)
ü fracture de la première côte
ü lésion du plexus brachial (rare) par:
ü compression du plexus brachial entre la 1ére
côte et la clavicule
ü chute du bras sur le côté de la table d'opération
ü saignement médiastinal
ü instabilité sternale par rupture d'une boucle
d'acier ou cisaillement de l'os par l'acier. Ce risque (1 à 3%) est aggravé par
l'obésité ou l'emphysème.
ü infections sternales (- de 1%)
La thoracotomie latérale peut être utilisée dans les chirurgies de l'aorte
l patient en décubitus latéral droit (hyperextension
latérale)
l abord au 4, 5, 6, ou 7ème espace
intercostal
l incision du bord interne de l'omoplate jusque sous
le sein gauche
l section du muscle grand dorsal
l section partielle des muscles trapèzes et rhomboïdes
si l'incision se situe dans le 3ème ou 4ème espace
intercostal
Risques :
ü fracture de côte
ü lésion du paquet vasculo-nerveux intercostal
ü les douleurs consécutives à l'intervention seront plus
importantes après thoracotomie
La circulation extracorporelle
est assurée par un appareillage cœur-poumon
artificiel qui permet d'assurer temporairement la fonction cardio-respiratoire
du patient. Le sang est intercepté aux niveaux des veines caves et réinjecté au
niveau de l'artère fémorale ou de l'aorte:

ý hypothermie relative (28 à
ý refroidissement local et arrêt du myocarde en
diastole par injection d'une solution cardioplégique potassique froide
ý stimulation du système nerveux autonome
ý augmentation très importante des catécholamines
régularisée 8 à 10 heures après l'opération
ý sécrétion du cortisol et des hormones thyroïdiennes
perturbée affectant le mécanisme lipidique
ý baisse de l'insulinémie
ý augmentation très importante de la glycémie
ý temps de récupération de 3 semaines pour les
capacités pulmonaires
Risques :
ü le risque de détresse respiratoire (2%) augmente
avec la durée de la
CEC
ü traumatisme des globules rouges et anémie maximale
engendré par la CEC entre le 7ème et 10ème jour
postopératoire
ü risque de paralysie temporaire du diaphragme gauche
par lésion du nerf phrénique
ü La CEC
et la mobilisation de petites plaques de calcaire peuvent
entraîner
des complications neurologiques (dégradation des fonctions
supérieures,
perte de la mémoire, troubles de la marche, troubles
sphinctériens,
atteinte du nerf cubital par compression), ulcères de stress
favorisés
par les AC et l'aspirine; l'anémie avec syndrome inflammatoire
survient
fréquemment
Les complications possibles de la chirurgie cardiaque
l hyposystolie, hypovolémie, avec faible débit
cardiaque
l tamponnade
l infarctus (5 à 7%)
l hémorragie médiastinale
l dissection aortique (rare) à l'endroit du clampage
ou du point de ponction
l troubles du rythme (25%)
l syndrome postpéricardiotomie
l fièvre, fatigue, anxiété, malaise général
l myalgies des épaules et de la nuque
l douleur inspiratoire
l tachypnée, respiration superficielle
l arythmie, frottements péricardiques
l épanchement pleural et/ou péricardique
l tamponnade
l détresse respiratoire aiguë post-CEC
l traumatisme du larynx
l œdème pulmonaire
l épanchements pleuraux
l atélectasie
l surinfection bronchique
l pneumothorax
l paralysie phrénique (gauche le plus souvent)
l œdème au niveau du site de prélèvement de la saphène
l douleurs musculo-articulaires au niveau du rachis,
des ceintures scapulaires et du thorax
l infection
l accidents vasculaires cérébraux
l pancréatite, hépatite
l troubles psychiques
l ulcère (stress)
l problèmes neurologiques (SPI ou SPE, sensibilité
sein gauche, perte de sensibilité du côté interne de la main par compression du
nerf cubital dans la gouttière épitrochléo-olécranienne)
l non consolidation du sternum
l sténose ou obstruction des pontages
l déhiscence valvulaire
l thrombus, embolies
l greffe bactérienne d'Osler sur la valve prothétique
l endocardite
l La correction chirurgicale de la coarctation de
l'aorte induit souvent une hypertension artérielle générale.
Avant une opération cardiaque, il est
conseillé
- un travail pré-opératoire visant à
apprendre au patient à mieux contrôler le couple abdomino-diaphragmatique soit:
gymnique, respiratoire et relaxation
- un travail gymnique des membres supérieurs
- des étirements des pectoraux
- une mobilisation de la ceinture scapulaire
et de la cage thoracique
- un travail en ouverture de la cage
thoracique
- un assouplissement costo-vertébral
- Apprentissage de la respiration
diaphragmatique et de l'accélération du flux expiratoire par la ventilation
dirigée
- Acquisition d'une expectoration efficace
- Acquisition de la technique de relaxation
pendant la respiration diaphragmatique.
La sternotomie médiane implique une
rééducation du diaphragme, donc des exercices à dominante respiratoire profonde
et un drainage bronchique. Le travail des cicatrices et les traitements
antalgiques sont importants. Les douleurs thoracique post-opératoires sont
souvent liées à la thoracotomie.
Le pontage coronaire est indiqué en cas de
sténose du tronc commun, sténose proximale si le réseau aval reste en bon état
et si la dilatation endoluminale percutanée (ballonnet) n'est pas envisageable
ou a échoué. Il s'agit de créer un pont entre l'aorte et l'artère coronaire au-delà
du rétrécissement, afin de rétablir l'approvisionnement en sang du myocarde.
Cette intervention n'est possible que si le
rétrécissement se situe à l'origine des artères.
l pratiqué fréquemment en CEC
l prélèvement de la veine saphène, céphalique ou
basilique
le prélèvement
de la veine saphène qui assure ± 10% du retour veineux, occasionne douleurs au niveau
du genou et œdème de la cheville, imposant massage circulatoire, drainage
lymphatique, pressothérapie, contention, électrothérapie.
l utilisation de l'artère mammaire gauche pour
revasculariser l'artère interventriculaire antérieure ou la diagonale
(technique la plus fréquente)
l utilisation de l'artère mammaire droite pour
revasculariser l'artère circonflexe. L'utilisation de l'artère mammaire
présente l'avantage d'une structure identique aux coronaires, d'un débit
cardiaque plus important, car le diamètre de l'artère mammaire est plus petit
que celui de la saphène, d'où risque diminué de thrombus, d'une meilleure
adaptation. L'utilisation de l'artère mammaire présente une plus grande
difficulté de dissection que la veine saphène, et une anastomose plus difficile
à
l L'angor disparaît dans 90% des cas après opération.
L'angioplastie
coronaire transluminale
Cette technique est utilisée essentiellement
pour des patients ayant une lésion monotronculaire prédominante. Elle consiste
à amener au niveau du rétrécissement de l'artère coronaire, par l'intérieur de
l'artère un ballonnet gonflable qui sera gonflé au niveau du rétrécissement
pour écraser la plaque d'athérome. Le ballonnet est introduit par l'artère
fémorale ou par l'artère radiale. Cette technique connaît un taux de succès de
plus de 85%. Il arrive parfois que la décision du pontage soit prise et
exécutée immédiatement pendant l'angioplastie. On peut également profiter de
l'angioplastie pour placer une endoprothèse ou stent qui est un treillis
métallique placé sur la paroi artérielle des grosses artères pour maintenir le
vaisseau ouvert.
Les risques sont l'échec technique (7%) et
la resténose (15 à 30%).


receveur
è en stade IV NYHA avec un pronostic vital inférieur à
un an
è âge maximum 65 ans
è fonctions rénales et hépatiques normales
è sans infarctus pulmonaire récent
è sans hypertension pulmonaire irréversible
è sans diabète insulino-dépendant
è sans maladie digestive
è sans maladie vasculaire cérébrale
è non alcoolique, ni drogué
è psychiquement sain
donneur
è hémodynamiquement compatible
è sans historique cardiaque
è écart maximum de
è en état de mort neurologique
è moins de 40 ans pour un homme et 50 ans pour une
femme, car le risque d'athérosclérose coronaire augmente avec l'âge
è origine: accident de la route, suicide par balle,
décès par cause neurologique
Le cœur est prélevé dans sa totalité par
sections éloignées de leur origine, immédiatement rincé dans une solution
saline glaciale pendant 10 minutes puis placé dans un conteneur d'une solution
saline glacée pour le transport. Le greffon dispose de 5 à 6 heures possibles
d'ischémie.
Les deux types d'intervention sont la
transplantation orthotopique où le cœur du donneur est raccordé sur une partie
des oreillettes du cœur du receveur et la transplantation hétérotopique où le
greffon est connecté en parallèle au cœur du receveur.
Dans la transplantation orthotopique, le
nœud sinusal du receveur reste en place avec les oreillettes postérieures. Dans
les deux cas de transplantation, il n'y a pas de réinnervation du cœur.
Les résistances vasculaires importantes dans
un contexte de post-ischémie froide forment le premier risque de défaillance du
greffon. Interviennent ensuite les risques de rejet du greffon et les risques
de problèmes infectieux majorés par le traitement immunosuppresseur.
Les capacités de vasodilatation artériolaire
du transplanté cardiaque se normalisent 3 mois après l'intervention, alors que
les œdèmes sont normalisés en quelques jours.
Les TC ont un VES au repos inférieur à celui
des sujets sains et une augmentation maximum possible à l'effort de VES de 40%.
La Fc de repos du cœur implanté est
supérieure à celle des sujets normaux du même âge et donc à celle du nœud
sinusal du receveur quel que soit le type de transplantation.
Certains transplantés cardiaques n'ont pas
de rythme sinusal propre pendant les premiers jours; ils ont un rythme
ventriculaire compris entre 30 et 40 bats/min et sont sous stimulateur.
L'augmentation de Fc provient de
l'augmentation de pression auriculaire droite, associée à l'augmentation du
retour veineux, puis à l'augmentation du taux plasmatique de noradrénaline.
La pression artérielle de repos des
transplantés traités à la cyclosporine (immuno-suppresseur) s'élève deux mois
après la transplantation du fait de l'insuffisance rénale, la diminution de
l'excrétion de sodium, et l'augmentation du volume intravasculaire. La
cyclosporine oblige 90% des transplantés cardiaques à suivre un traitement
hypotenseur. Les résistances périphériques ne se normalisent pas complètement.
Par contre, en 3 mois, la capacité de vasodilatation artérielle se normalise.
Chez les transplantés récents, lors des deux
premières minutes du retour au calme, après l'effort, Fc continue à augmenter
du fait vraisemblablement d'une élévation du taux de noradrénaline plasmatique.
Lors du retour au calme, le retour vers la Fc initiale est plus lent (20
minutes) que chez le sujet sain. A l'effort, l'augmentation de PAS est linéaire
à l'intensité de l'effort.
La transplantation cardio-pulmonaire
receveur
è souffrant d'HTA pulmonaire primitive, cardiopathies
congénitales avec syndrome d'Eisenmenger, cardiopathies avec résistances
vasculaires pulmonaires élevées, affections broncho-pulmonaires primaires
è âge maximum 50 ans
è autres contre-indications identiques à la
transplantation cardiaque
donneur
è mêmes caractéristiques que celui de la
transplantation cardiaque
è pas d'historique pulmonaire
è le greffon devra être légèrement plus petit que la
cage thoracique du receveur
La transplantation est orthotopique.
L'œdème pulmonaire de réimplantation dû à
l'interruption du drainage lymphatique et à l'ischémie du poumon pendant le
transport constitue un risque important jusqu'à JPO + 15.
La dénervation pulmonaire entraîne une
paralysie du mouvement ciliaire augmentant le risque d'infection, la
suppression du réflexe de toux et une modification du contrôle de la
ventilation avec de plus grands volumes et une moins grande fréquence
respiratoire.
Nota: le nombre de transplantations
cardiaques est aujourd'hui fortement en baisse (-30% en 1996) du fait du manque
de donneurs, de problèmes juridiques, culturels, religieux, du prix, des
difficultés de suivi et de l'apparition d'autres techniques.
Autres interventions chirurgicales
 þ réparation d'anévrisme
ventriculaire gauche pour exciser un important tissu dyskinétique et éliminer
les thrombus résiduels
þ réparation d'anévrisme
ventriculaire gauche pour exciser un important tissu dyskinétique et éliminer
les thrombus résiduels
þ réparation d'une communication interventriculaire
post infarctus
 þ réparation d'une
dysfonction mitrale post infarctus
þ réparation d'une
dysfonction mitrale post infarctus
þ réparation d'une dissection aortique
þ réparation ou échange d'une valve
þ péricardectomie ou décortication cardiaque pour
libérer les adhérences créées par la fibrose ou calcification du péricarde et
de l'endocarde qui compresse les chambres cardiaques
þ implantation d'un stimulateur cardiaque
- alimenté par
une pile au lithium
- traitement des
bradycardies ou des tachycardies
- programmation
externe d'une ou plusieurs fonctions
- par code à 3
lettres
1ère
lettre pour le lieu de stimulation
A = auriculaire,
V = ventriculaire, D= A et V
2ème
lettre pour le lieu de détection (A V D )
3ème
lettre
I = Inhibition de
la décharge par détection d'une activité cardiaque spontanée
T = activés par
la détection d'une activité cardiaque spontanée
D = activés par
la détection d'une activité auriculaire et décharge dans le ventricule
Nota:
Une distance de
portable
et le stimulateur est conseillée.
þ
implantation d'un défibrillateur
þ chirurgie des tachyarythmies
Nouvelles
techniques chirurgicales
Il existe de nouvelles techniques comme:
F
le laser transmyocardique (coût entre 1 500 000 et 4 000 000 FF) pour créer des
micro canaux,
F
la chirurgie mini invasive sans ouverture du thorax (coût d'un remplacement de
valve avec cette technique 30 000 FF, car les sondes sont très chères).
F
la résection de la plaque d'athérome par technique invasive.
F
la cardiomyoplastie restitue ou augmente la contractilité myocardique en
utilisant le muscle grand dorsal du patient. Le chirugien transfère le muscle
grand dorsal gauche à travers une fenêtre réalisée dans la paroi thoracique par
résection partielle de la 2ème côte autour des ventricules
défaillants. Le muscle renforcera la systole ventriculaire dans les
cardiomyopathies ischémiques ou dilatées ou remplacera le myocarde après
résection d'un anévrisme important.. Cette technique nécessite l'assistance
d'un système d'électro-stimulation comportant deux électrodes de stimulation
musculaire, deux électrodes de détection de la systole ventriculaire et un
stimulateur implantable. La cardiomyoplastie s'adresse préférentiellement aux
patients en insuffisance cardiaque chronique sévère. L'opération ne nécessite
pas de CEC, engendre peu de séquelles fonctionnelles du bras; elle ne comporte
pas de risque de rejet et donc ne nécessite pas de traitement immunosupresseur.

La prise en
charge secondaire de l'infarctus
Après la phase aiguë de l'infarctus, il faut
éviter une récidive, réadapter le patient et contrôler les facteurs de risques
cause de l'accident par prévention.
Le patient sera donc évalué et surveillé
par:
F
ECG
F
Radiographie thoracique
F
Contrôles biologiques
F
Evaluation de la fonction rénale
F
Des examens cardiaques usuels
- Echographie
avec doppler cardiaque par voie trans-thoracique (ETT)
- innocuité
totale
-
renseignements:
- dimension des cavités cardiaques et
étendue de la
zone akinétique
- visualisation d'un thrombus mural,
d'un
épanchement
péricardique,
- détection et
quantification d'une insuffisance mitrale, d'une communication
interventriculaire (CIV)

- évaluation
d'un retentissement cardiaque droit et
des pressions
pulmonaires
- Echographie
par voie trans-oesophagienne (ETO)
- en cas de
doute sur des lésions de l'aorte, sur un thrombus intra-auriculaire gauche ou
pour préciser une détérioration de l'appareil valvulaire mitral
- Recherche de
potentiels ventriculaires tardifs
- réalisée par
enregistrements ECG à haute amplification. Leur présence traduit un risque
élevé de troubles rythmiques ventriculaires graves et de mort subite; leur
absence traduit un risque faible. On les retrouve essentiellement après un
infarctus étendu.
3 critères: - durée du QRS > 110 ms
- durée du signal < 40
µV
- amplitude moyenne de ce
signal < 20 µV
- Epreuve
d'effort
- Enregistrement
ECG continu de 24 h (HOLTER)
Souvent réalisé
en fin de rééducation, il accompagne la reprise des activités courantes. Il est
destiné à repérer des arythmies, principalement ventriculaires qui peuvent être
asymptomatiques et péjoratives.
-
Enregistrement tensionnel continu de 24 h (MAPA)
-
Coronarographie
C'est l'examen
de référence pour apprécier la localisation et l'importance des sténoses
coronaires, et des risques encourus par l'état des coronaires. Elle permet de
déterminer le mode d'intervention éventuel (angioplastie ou pontage), et de
quantifier les conséquences ventriculaires gauches de l'infarctus et de
vérifier l'efficacité d'une thrombolyse ou d'une angioplastie.
Elle est
réalisée par voie artérielle rétrograde radiale ou fémorale, sous anesthésie
locale. Elle comporte la visualisation des réseaux coronaires droit et gauche,
la mesure des pressions dans l'aorte et le VG et l'opacification du ventricule.
Son risque est
faible (0.5/1000) lié à l'instabilité de patients à haut risque.
- Analyse de la
contractilité segmentaire par échographie ou angiographie qui permet
d'apprécier dans les jours ou semaine qui suivent l'infarctus l'importance de
la zone non nécrosée mais non fonctionnelle due soit à un myocarde sidéré
susceptible de récupérer spontanément si il reste suffisamment perfusé, soit à
un myocarde hibernant, hypo-perfusé qui ne pourra récupérer qu'après
rétablissement de la perfusion.
u La sidération myocardique (dysfonction ventriculaire prolongée) peut survenir même pour des occlusions de moins de 20 minutes et revenir plus ou moins tardivement à la normale.
u L'hibernation du myocarde caractérise un myocarde conservant ses myocites, mais dont la contraction est diminuée de façon chronique. Le flux coronaire résiduel empêche la nécrose.
u Le préconditionnement est l'adaptation rapide du myocarde à une ischémie brève, qui permet de diminuer la vitesse avec laquelle la mort cellulaire survient lors d'un accident ultérieur prolongé dans les 24 heures maximum.
F
Les explorations isotopiques classiques
- La scintigraphie myocardique au thallium
pour quantifier la zone de nécrose



La scintigraphie myocardique utilise le
thallium (essentiellement) comme marqueur, car le thallium entre de manière
passive dans la cellule myocardique. Apporté par la circulation coronaire, il
est d'autant plus fixé que la circulation est importante; il ne peut se fixer
dans les cellules nécrosées. Une gamma caméra va permettre de prendre des
images de l'activité du myocarde et de déterminer les zones nécrosées ou à
faible circulation.
La sensibilité de la scintigraphie est de
80%.
- La ventriculographie isotopique permet une
mesure de la fraction d'éjection

- L'échographie de stress permet d'étudier
la viabilité myocardique. Elle se pratique par une épreuve d'effort ou sous
perfusion de dobutamine pour recréer les conditions de la défaillance.
Le bilan devra révéler l'étendue de la
nécrose et déterminer l'étendue éventuelle de la maladie athéromateuse.
Contrôle des facteurs de risque et
information du patient
Les facteurs de risque devront être mis en
évidence pour être contrôlés. Ce chapitre très important de la prévention rend
indispensable l'information et la participation du patient.
Les points suivants devront impérativement
être respectés:
-
arrêt du tabagisme (50 à 70% de diminution du risque de récidive)
-
contrôle de l'hypertension
-
contrôle du diabète et des hypercholestérolémies
-
réduction pondérale
-
respect de l'hygiène diététique
-
activité physique
-
diminution du stress
Elle permet d'obtenir notamment une baisse
de la mortalité de 20 à 25%. Cette thérapie est détaillée plus loin dans
l'ouvrage.
Ces comprimés (type Trinitrine) à croquer ou
à laisser sous la langue, ou en spray à pulvériser ont une action rapide qui
dilate les vaisseaux sanguins y compris les artères coronaires et diminue le
travail cardiaque. A forte dose, les DN ont une action artérielle. Ils sont
utilisables en cas de douleur angineuse. Il n'y a aucune accoutumance, et ces
produits sont utilisables à titre préventif avant un effort ou par temps froid.
Les effets de la trinitrine durent environ 20 à 30 minutes. Les DN sont prescrits
dans l'insuffisance coronaire et dans la décompensation cardiaque. Ils ne sont
pas utilisés dans l'infarctus du ventricule droit en raison du risque
d'hypotension par baisse de
Ils peuvent entraîner une séquestration
veineuse au niveau des membres inférieurs; ils peuvent induire des maux de
tête.
Les inhibiteurs du calcium (IC)
Ils agissent comme vasodilatateurs
artériels, veineux et coronaires en bloquant les canaux calciques présents dans
les muscles lisses vasculaires. Ils interviennent en diminuant le tonus
vasoconstricteur des muscles lisses vasculaires, en augmentant la
vasodilatation coronaire et par un effet bradycarde sur les tissus myocardiques
nodaux. Les IC éliminent l'angor, baissent TA et régularisent le rythme avec
ralentissement partiel du rythme
Leur tolérance est le plus souvent bonne
avec quelques fois l'apparition de gonflement des chevilles sans aucune
gravité.
Une accélération faible du rythme cardiaque
liée à une Fc de repos faible est une bonne indication des inhibiteurs du
calcium. Les IC sont antiangineux (en association avec les b B et
hypotenseurs. Ils possèdent un effet anti-arythmique à l'étage auriculaire avec
prévention des tachycardies supraventriculaires paroxystiques. Ils sont
utilisés dans le traitement des ESV. Les indications essentielles sont:
-
traitement du spasme coronaire
-
hypertension artérielle
-
ischémie myocardique
-
traitement de l'angor
-
traitement de certaines arythmies ventriculaires
-
traitement et prévention des déficits neurologiques conséquences d'une
rupture
anévrismale
Les IC diminuent les besoins en oxygène du
myocarde grâce à une diminution de la post-charge du ventricule gauche.
A l'effort, chez les hypertendus traités par
IC, on note des baisses de TAS et TAD du fait d'une diminution des résistances
vasculaires. Les IC n'influencent ni VO2 Max ni les effets de
l'entraînement.
Les IC sont déconseillés chez les sujets et
particulièrement les femmes ayant un mauvais état veineux des membres
inférieurs. Ils sont particulièrement indiqués chez les sujets jeunes et
désirant faire du sport, et chez les hypertendus ayant une maladie
polyartérielle.
Ces médicaments ont pour but de prévenir la
formation de caillot. Cet effet anticoagulant est à surveiller de façon
régulière par des prises de sang. Il existe un risque hémorragique, qu'on
constate par des saignements de gencives ou des urines rouges qui doivent faire
consulter. Sous traitement anticoagulant, il ne faut pas prendre, sauf avis
médical, des médicaments comme l'aspirine ou ses dérivés. Il en est de même des
piqûres intramusculaires ou des infiltrations intra-articulaires qui peuvent
être dangereuses en provoquant des hématomes. L'alcool et certains médicaments
comme les AINS et la majorité des antalgiques potentialisent les effets des
anticoagulants. A l'inverse les antiacides, les barbituriques ou les
contraceptifs oraux inhibent l'effet des AC.
 Ces médicaments ralentissent le cœur et diminuent les besoins en oxygène
du muscle cardiaque en bloquant les récepteurs b -adrénergiques. Les
bêta-bloquants ralentissent Fc au repos et à l'effort de 10%, baissent TA.
Ces médicaments ralentissent le cœur et diminuent les besoins en oxygène
du muscle cardiaque en bloquant les récepteurs b -adrénergiques. Les
bêta-bloquants ralentissent Fc au repos et à l'effort de 10%, baissent TA.
Ils préviennent efficacement les arythmies
ventriculaires d'effort en diminuant le tonus sympathique et en réduisant
l'ischémie.
Une accélération rapide du rythme cardiaque
avec forte hausse tensionnelle est une bonne indication des bêtabloquants. Ils
sont prescrits dans les cardiopathies ischémiques et dans l'hypertension
artérielle. L'effet cardio-protecteur est la justification principale de leur
prescription en première intention.
Les pathologies non coronaires qui
présentent une sous-dénivellation du segment ST normalisée par les
bêtabloquants sont: prolapsus de la valve mitrale, maladie cardiaque
hypertensive, état circulatoire hyperdynamique lié aux excès de sécrétion des
catécholamines, cardiomyopathie...
La prise de bêtabloquants peut s'accompagner
d'effets secondaires comme la fatigue, la froideur des extrémités, des troubles
digestifs et parfois l'impuissance sexuelle. Ils peuvent être quelquefois mal
supportés, notamment chez les asthmatiques. Ils peuvent de plus entraîner un
essoufflement, une fatigue qui disparaissent au bout de quelques jours et
parfois favoriser un spasme. Les b -bloquants sont déconseillés chez les artéritiques,
les asthmatiques, et les DID. Ils sont conseillés dans le traitement des
coronariens hypertendus.
La prescription d'antiagrégants plaquettaires
tels l'aspirine ne nécessite plus la surveillance du taux de prothrombine. Les
AA sont prescrits après tout accident ou intervention vasculaire. Dans le cadre
d'une revascularisation coronaire, les AA préviennent la thrombose des pontages
coronaires et doivent être utilisés pendant au moins un an après
l'intervention. L'aspirine en association avec la streptokinase réduit la
mortalité de 42% à 5 semaines. Les AA évitent les troubles du rythme. Une étude
a mis en évidence la prévention de l'attaque cardiaque dans 50% de la
population étudiée, et une diminution des gravités de l'attaque pour les 50%
restant.
En association avec aspirine et un
thrombolytique (alteplase), elle permet de maintenir l'artère coronaire
perméable et de prévenir les accidents thrombo-embolitiques veineux ou
artériels.
Ils permettent une reperfusion rapide. Ils
doivent être systématiquement prescrits sur des IDM de moins de 6 h. Des
complications hémorragiques peuvent survenir. Ils sont contre-indiqués en cas
de accident ischémique cérébral, même ancien, d'hémorragie cérébrale, même
ancienne, d'HTA non contrôlée, de chirurgie intracrânienne de moins de 6 mois,
de pose de prothèse en dacron de moins de 2 mois, de coronarographie ou
ponction lombaire de moins d'une semaine, de toute chirurgie ou traumatisme
récent. 75 mg d'aspirine par jour diminue la fréquence d'IDM.
Anticoagulants, ils sont discutés du fait du
risque hémorragique et des interactions médicamenteuses qu'ils comportent. Leur
usage est limité essentiellement aux suites d'infarctus compliquées de thrombus
intra-cavitaire, de troubles rythmiques auriculaires et d'insuffisance
cardiaque avec dilatation cavitaire.
Les transplantés cardiaques reçoivent à vie
un traitement anti-rejet dont
Ce sont des hypotenseurs qui inhibent le
système nerveux orthosympathique périphérique.
Ils favorisent une tachycardie réflexe et
une rétention hydrosalée. Ils sont utilisés dans le traitement de l'HTA et de
la décompensation cardiaque.
Ils ralentissent la conduction
auriculo-ventriculaire. En cas de fibrillation auriculaire (FA), ils ralentissent
la réponse ventriculaire. Ils sont prescrits chez les patients atteints de
valvulopathie mitrale et dans l'insuffisance cardiaque avec FA associée. Les
digitaliques augmentent la résistance cardiaque et produisent des effets
secondaires lors du surdosage.
En s'opposant à la rétention sodée, ils
favorisent une élimination rénale d'eau et de sel. Ils sont prescrits dans le
traitement de l'HTA (déplétion en sodium des cellules musculaires lisses de la
paroi artérielle la rendant moins sensible aux stimuli vaso-constricteurs, d'où
une baisse des résistances artériolaires), car ils baissent
Ils possèdent néanmoins certains
inconvénients:
-
action stimulante des facteurs de croissance vasculaires dont
l'angiotensine
II
-
élévation possible de l'uricémie
-
action hypokaliémiante
-
effets aggravants sur le syndrome métabolique des hypertendus
(insulino-résistance, augmentation des lipides
sanguins, hyperuricémie)
-
effets secondaires dose-dépendants gênant pour le patient
Les diurétiques sont le plus souvent
associés à d'autres médicaments et notamment les IEC pour combattre ces
inconvénients.
Ils permettent la correction de
l'hypercholestérolémie. Leurs résultats sont plus flagrants sur des hypercholestérolémies
modérées. On en distingue trois classes:
- les résines
- les fibrates agissant sur les mécanismes
de dégradation des TG. Les fibrates présentent deux risques: la
potentialisation des antivitamines K et une lyse musculaire manifestée par une
élévation des CPK à surveiller annuellement.
- les statines inhibitrices d'une enzyme de
la synthèse du cholestérol intracellulaire, possèdent en outre une action
préventive des AVC (-14.5% en prévention primaire, - 30% en prévention
secondaire).
Les inhibiteurs de l'enzyme de conversion (IEC)
antihypertenseurs puissants, par
l'inhibition de l'enzyme de conversion de l'angiotensine, ils limitent les
modifications anatomiques et fonctionnelles de l'endothélium; ils limitent donc
le développement de la dysfonction ventriculaire gauche en réduisant la
dilatation de la cavité ventriculaire. Ils sont prescrits dès le 1er
ou 2ème jour. Ils sont indispensables en cas de fraction d'éjection
inférieure à 40%.
Ils inhibent la vasoconstriction de
l'avant-bras induite par la stimulation sympathique. Ils rétablissent la
vasodilatation flux-dépendante des artères coronaires. Les IEC peuvent moduler
l'activité sympathique.
Les IEC sont potentialisés par les diurétiques.
L'effet première dose est une hypotension
artérielle réactionnelle significative lors d'une première prise d'IEC (2 à
30%). Les IEC peuvent aussi entraîner des troubles de la fonction rénale et des
toux incoercibles.
Eviter les inhibiteurs de l'enzyme de
conversion dans la thérapeutique de revascularisation essentiellement par
angioplastie, chez les bronchitiques chroniques. Les IEC sont indiqués dans le
traitement des hypertendus ayant une surcharge pondérale.
Mécanisme de l'angiotensine et de la bradykinine
 L'angiotensine est la plus puissante substance vasoconstrictrice de
l'organisme. Elle élève l'état tensionnel des artères en les contractant. La
rénine sécrétée par les reins transforme l'angiotensinogène en angiotensine I
inactive. L'enzyme de conversion transforme l'angiotensine I inactive en
angiotensine II active.
L'angiotensine est la plus puissante substance vasoconstrictrice de
l'organisme. Elle élève l'état tensionnel des artères en les contractant. La
rénine sécrétée par les reins transforme l'angiotensinogène en angiotensine I
inactive. L'enzyme de conversion transforme l'angiotensine I inactive en
angiotensine II active.
La deuxième voie
intervient sur le mécanisme tensionnel, celle de la bradykinine vasodilatatrice
et normalement dégradée par l'enzyme de conversion. Les IEC en s'opposant à
cette dégradation prolongent l'action vasodilatatrice.
Les
anxiolytiques et antidépresseurs
Ils permettent de lutter contre la
dépression.
Essentiellement à base de morphine
Les agonistes des canaux potassiques
Par l'activation des canaux potassiques, ils
diminuent le travail ventriculaire gauche et augmentent les apports en oxygène
par dilatation artérielle et veineuse, dilatation coronaire et activité
antispastique.
Ils stimulent la production d'EDRF/NO
(facteur relaxant dérivé de l'endothélium) afin de protéger les cellules
endothéliales contre diverses agressions (agrégation plaquettaire, augmentation
brutale du flux sanguin…). On retrouve un dysfonctionnement endothélial dans la
maladie coronaire, l'HTA essentielle, l'insuffisance cardiaque congestive,
l'hypertension pulmonaire, le diabète.
Ils sont complémentaire des bêtabloquants et
des IC. Ce type de traitement peut parfois s'accompagner de céphalées.
Choix de
l'anti-hypertenseur en première intention
|
Classe |
Indications préférentielles |
Contre-indications |
|
Diurétiques |
Hypertension modérée Sujets de race noire |
Sujets obèses Diabétiques Association biguanide |
|
Bêtabloquants |
Coronariens |
Artéritiques Asthmatiques Diabétiques |
|
IEC |
Sportifs Obèses |
Bronchitiques chroniques |
|
Inhibiteurs calciques |
Sportifs Coronariens |
Mauvais état veineux |
